
合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题:
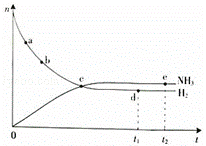
(1)对于密闭容器中的反应:N2(g)+3H2(g)═2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如右下图所示.
下列叙述正确的是 (填选项).
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
(2)已知N2(g)+3H2 (g)═2NH3(g)△H=﹣92.4kJ•mol﹣1
①合成氨工业采取的下列措施不可用平衡移动原理解释的是 (填选项).
A.采用较高压强(20MPa~50MPa)
B.采用500℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来
②合成氨工业中采用了较高压强(20MPa~50MPa),而没有采用100MPa或者更大压强,试解释没有这么做的理由 .
③在容积均为2L(容器体积不可变)的甲、乙两个容器中,分别加入2molN2、6molH2和1molN2、3molH2,在相同温度、催化剂下使其反应.最终达到平衡后,两容器N2转化率分别为α甲、α乙,则甲容器中平衡常数表达式为 (用含α甲的代数式表示,化简为最简式),此时α甲 α乙(填“>”、“<”“=”).
| 物质的量或浓度随时间的变化曲线;化学平衡移动原理;化学平衡的计算.. | |
| 专题: | 化学平衡专题. |
| 分析: | (1)在N2(g)+3H2(g)⇌2NH3(g)反应中,随着反应的进行,反应物的物质的量逐渐减少,生成物的物质的量逐渐增多,当达到平衡状态时,反应物的生成物的物质的量不再改变,曲线为水平直线,以此判断题中各项; (2)①勒沙特列原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,勒沙特列原理适用的对象应存在可逆过程,如与可逆过程无关,与平衡移动无关,则不能用勒沙特列原理解释; ②考虑工业生产成本和技术问题; ③根据三段式计算各组分的浓度,再根据平衡常数计算公式计算. |
| 解答: | 解:(1)A.随着反应的进行,反应物的浓度之间减小,反应速率逐渐减小,则a点的正反应速率比b点大,故A正确; B.c点反应物和生成物物质的量仍在变化,没有达到平衡状态,故B错误; C.d点和e点都处于平衡状态,n(N2)不变,d点和e点n(N2)相等,故C错误; D.该反应正反应是放热反应,温度升高平衡向逆反应移动,氢气的物质的量增大,故D正确; 故答案为:A、D; (2)①A、高于常压,增大压强,化学平衡会正向移动,有利于氨气的合成,能用勒沙特列原理解释,故错误; B、500℃的高温,不有利于氨气的合成,但是可以提高催化剂的催化活性,不能用勒沙特列原理解释,故正确; C、铁触媒作催化剂,不会引起化学平衡的移动,不能用勒沙特列原理解释,故正确; D、将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中,都会使得化学平衡正向移动,有利于氨的合成,能用勒沙特列原理解释,故错误; 故选B、C; ②虽然增大压强,化学平衡会正向移动,有利于氨气的合成,但是压强越大,消耗的动力越大,对设备的要求越高,而总体经济效益提高不大, 故答案为:压强越大,消耗的动力越大,对设备的要求越高,而总体经济效益提高不大; ③N2(g)+3H2(g)═2NH3(g) 起始(mol/L) 1 3 0 变化(mol/L) x 3x 2x 平衡(mol/L) 1﹣x 3﹣3x 2x N2转化率分别为α甲=,x=α甲, 平衡常数K= 甲的压强大于乙的压强,平衡右移,N2转化率增大,故α甲>α乙, 故答案为: |
| 点评: | 本题考查较综合,涉及化学平衡的计算、影响平衡的因素等,注重高考常考查点的考查,题目难度中等. |


科目:高中化学 来源: 题型:
下列实验“操作和现象”与“结论”都正确的是
| 操作和现象 | 结论 | |
| A | 切开金属钠,钠表面的银白色会逐渐褪去 | Na在空气中会生成Na2O2 |
| B | 铝箔插入浓硝酸中,无明显现象 | 铝与浓硝酸不反应 |
| C | 将FeCl2溶液滴加到少许酸性KMnO4溶液中,溶液褪色 | FeCl2具有漂白性 |
| D | 向Fe(NO3)2溶液中滴加稀硫酸和KSCN溶液,溶液变成红色 | 溶液中有Fe3+生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁4中物质分别含2种或3种元素,它们的分子中各含18个电子.甲是气态氢化物,在水中分步电离出两种阴离子.下列推断合理的是( )
|
| A. | 某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 |
|
| B. | 乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键 |
|
| C. | 丙中含有二周期IVA族的元素,则丙一定是甲烷的同系物 |
|
| D. | 丁和甲中各元素质量比相同,则丁中一定含有﹣1价的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
镁电池毒性低、污染小,电压高而平稳,它逐渐成为人们研制绿色电池的关注焦点.其中一种镁电池的反应原理为:xMg+Mo3S4 Mg2Mo3S4,下列说法不正确的是( )
Mg2Mo3S4,下列说法不正确的是( )
|
| A. | 放电时,Mo3S4发生氧化反应 |
|
| B. | 放电时,正极反应式:Mo3S4+2xe﹣→Mo3S42x﹣ |
|
| C. | 充电时,Mg2+向阴极迁移 |
|
| D. | 充电时,阴极反应式:xMg2++2xe﹣→xMg |
查看答案和解析>>
科目:高中化学 来源: 题型:
氨、甲烷都是重要的氢化物,按要求回答下列问题:
(1)NH3(g)和O2(g)反应生成NO(g)和H2O(g)的△H往往难以直接测量,从产物稳定性看,其主要原因是 .
已知:1molN2(g)反应生成2mol NH3(g)的△H=﹣92kJ•mol﹣1,1mol H2(g)燃烧生成H2O (g) 的△H=﹣242kJ•mol﹣1,1mol N2(g)和O2 (g)完全反应生成NO(g)的△H=+180kJ•mol﹣1.若有17g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为 .
(2)甲烷与水蒸气通入聚焦太阳能反应器,可发生反应的化学方程式为CH4+H2O⇌CO+3H2,该反应为吸热反应.已知在三种不同条件(Ⅰ、Ⅱ、Ⅲ)下,氢气的产量随时间的变化如图1所示.
①在0~20小时内,甲烷的反应速率vⅠ、vⅡ和vⅢ从大到小的顺序为 .
②将0.4mol甲烷和0.4mol水蒸气充入2L恒容的密闭容器中,某条件下反应达到平衡,测得氢气的物质的量浓度为0.3mol•L﹣1,则该条件下此反应的平衡常数K= ,甲烷的转化率为 .
③氢气的百分含量与体系总压强(P)、温度(T)的关系如图2所示.
平衡状态由A变到B时,对应的平衡常数:K(A) K(B)(填“>”、“<”或“=”).
查看答案和解析>>
科目:高中化学 来源: 题型:
根据有机物的命名原则,下列命名正确的是( )
|
| A. |
|
|
| B. | CH3CH(C2H5)CH2CH2CH3 2﹣乙基戊烷 |
|
| C. | CH3CH(NH2)CH2COOH α﹣氨基丁酸 |
|
| D. | 3,3﹣二甲基﹣2﹣丁醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
卤素单质及化合物在许多性质上都存在着递变规律.下列有关说法正确的是( )
|
| A. | 卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深 |
|
| B. | 卤化氢的键长按H﹣F、H﹣C1、H﹣Br、H﹣I的顺序依次减小 |
|
| C. | 卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱 |
|
| D. | 卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:4NH3+5O2 4NO+6H2O,4NO+3O2+2H2O→4HNO3
4NO+6H2O,4NO+3O2+2H2O→4HNO3
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80.
(1)a mol NO完全转化为HNO3理论上需要氧气 mol.
(2)为使NH3恰好完全氧化为NO,氨﹣空气混合气体中氨的体积分数(用小数表示)为 (保留2位小数).
(3)20.0mol NH3用空气氧化,产生混合物的组成为:NO 18.0mol、O2 12.0mol、N2 150.0mol和一定量硝酸,以及其他成分(高温下NO与O2不化合).计算氨转化为NO和HNO3的总转化率.
(4)20.0mol NH3和一定量空气充分反应后,再转化为硝酸.通过计算,在图中画出HNO3的物质的量n(A)和空气的物质的量n(B)关系的理论曲线.
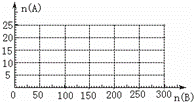
查看答案和解析>>
科目:高中化学 来源: 题型:
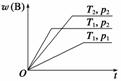
密闭容器中进行的可逆反应:aA(g)+bB(g) cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示。下列判断正确的是 ( )
cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示。下列判断正确的是 ( )
A.T1<T2,p1<p2,a+b>c,正反应为吸热反应
B.T1>T2,p1<p2,a+b<c,正反应为吸热反应
C.T1<T2,p1>p2,a+b<c,正反应为吸热反应
D.T1>T2,p1>p2,a+b>c,正反应为放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com