
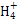 、Cl-、S2-
、Cl-、S2-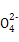 、K+
、K+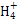 、Na+、Cl-、Cu2+
、Na+、Cl-、Cu2+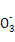 、Mn
、Mn
| A.②③ | B.①③ | C.③④ | D.①⑤ |
科目:高中化学 来源:不详 题型:填空题
| A.③①④② | B.①③④② | C.④②①③ | D.④②③① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32—、AlO2— |
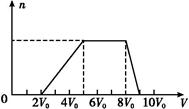
| Cl2的体积(标准状况) | 11.2 L | 22.4 L | 28.0 L |
| n(Cl-) | 2.5 mol | 3.5 mol | 4.0 mol |
| n(Br-) | 3.0 mol | 2.5 mol | 2.0 mol |
| n(I-) | x mol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
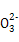 、OH- 6种离子中的3种,已知甲溶液呈蓝色,则乙溶液中大量存在的离子是( )
、OH- 6种离子中的3种,已知甲溶液呈蓝色,则乙溶液中大量存在的离子是( )A.K+、OH-、C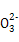 | B.Cu2+、H+、Cl- |
| C.K+、H+、Cl- | D.C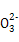 、OH-、Cl- 、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.平衡常数的大小与温度、浓度、压强、催化剂等有关 |
| B.当温度升高时,弱酸的电离平衡常数Ka变小 |
| C.Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能够发生 |
| D.Ka(HCN)<Ka(CH3COOH),说明物质的量浓度相同时,氢氰酸的酸性比醋酸强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H++A2-。
H++A2-。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH小于4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.200 mol·L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度: ④>①>②>③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com