将0.23g金属钠投入到100ml水中,使其充分反应,假设反应后溶液的体积不变.试计算:
(1)反应后所得溶液溶质的物质的量浓度是多少?
(2)产生标准状况下的气体多少毫升?
【答案】
分析:(1)钠与水发生反应2Na+2H
2O=2NaOH+H
2↑,根据n=

金属Na的物质的量,由方程式计算n(NaOH),再根据c=
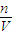
计算形成的氢氧化钠溶液的浓度.
(2)令生成氢气的物质的量为xmol,根据方程式2Na+2H
2O=2NaOH+H
2↑计算x的值,再根据V=nVm计算氢气的体积.
解答:解:(1)0.23g金属钠的物质的量为
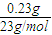
=0.01mol,
令生成的氢氧化钠的物质的量为ymol,则:
2Na+2H
2O=2NaOH+H
2↑
2 2
0.01mol ymol
所以2:2=0.01mol:ymol,解得y=0.01mol
故所得氢氧化钠溶液的物质的量浓度为

=0.1mol/L.
答:反应后所得溶液溶质的物质的量浓度是0.1mol/L.
(2)令生成氢气的物质的量为xmol,则:
2Na+2H
2O=2NaOH+H
2↑
2 1
0.01mol xmol
故2:1=0.01mol:xmol,解得x=0.005
故标准状况下氢气的体积为0.005mol×22.4L/mol=0.112L=112mL.
答:产生的氢气在标准状况下的体积为112mL.
点评:考查根据方程式的计算、常用化学计量的有关计算等,比较基础,注意基础知识的掌握.

 金属Na的物质的量,由方程式计算n(NaOH),再根据c=
金属Na的物质的量,由方程式计算n(NaOH),再根据c=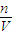 计算形成的氢氧化钠溶液的浓度.
计算形成的氢氧化钠溶液的浓度.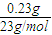 =0.01mol,
=0.01mol, =0.1mol/L.
=0.1mol/L.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案