
N2O俗称“笑气”,曾用作可吸入性麻醉剂,下列反应能产生N2O :3CO+2NO2=3CO2+N2O.下列关于N2O的说法一定正确的是
A.上述反应,每生成lmol N2O,消耗1.5mol CO
B.等物质的量的N2O和CO2含有相等的电子数
C.N2O只有氧化性,无还原性
D.N2O会迅速与人体血红蛋白结合,使人中毒
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源:2016届江苏省高三上学期开学考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s)的ΔH<0
B.常温下,BaSO4分别在相同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液中的溶解度相同
C.常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4)
D.等体积、等物质的量浓度的NH3·H2O溶液与NH4Cl溶液混合后溶液呈碱性,说明NH3·H2O的电离程度小于NH的水解程度
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三上学期起点考试化学试卷(解析版) 题型:填空题
医学上常用酸性高锰酸钾溶液和草酸溶液的反应来测定血钙的含量。回答下列问题:
______H++______MnO4-+______H2C2O4→______CO2↑+______Mn2++______□
(1)配平以上离子方程式,并在□中填上所需的微粒。
(2)测定血钙的含量:取2 mL 血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4 溶液,反应生成CaC2O4 沉淀,将沉淀用稀硫酸溶解得到H2C2O4 后,再用KMnO4 溶液滴定。稀硫酸溶解CaC2O4 沉淀的化学方程式是_________________。
(3)溶解沉淀时 (“能”或“不能”)使用稀盐酸。
(4)若消耗了1.0×10-4 mol·L-1 的KMnO4 溶液40.00 mL,则100 mL 该血液中含钙_____g。
(5)医学研究表明,肾结石主要是由CaC2O4 [Ksp(CaC2O4)=2.3×10-9 ] 组成的,若血液经血小球过滤后,形成的尿液为200 mL,其中含有Ca2+ 0.01 g。为了使不形成CaC2O4 沉淀,则C2O42-的最高浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏回族自治区银川一中高三上学期第一次月考化学试卷(解析版) 题型:选择题
在酸性高锰酸钾溶液中加入过氧化钠粉末,溶液褪色,其中发生反应的离子方程式为:2MnO4-+16H++5Na2O2===2Mn2++5O2↑+8H2O+10Na+。下列判断正确的是
A.O2是还原产物,Mn2+是氧化产物
B.Na2O2既是氧化剂,又是还原剂
C.标准状况下,产生22.4 L O2时反应转移2 mol e-
D.通常用浓盐酸酸化高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三上学期第一次质检化学试卷(解析版) 题型:选择题
用下列实验装置进行相应实验,能达到实验目的的是

A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源:2016届河南省郑州市新高三年级调研检测化学试卷(解析版) 题型:选择题
以下比较中,正确的是
A.微粒半径;O2-<F-<Na+<Li+
B.晶格能由大到小:NaI>NaBr>NaCl>NaF
C.分子中的键角:CH4>H2O>CO2
D.共价键的键能:C—C>C—Si>Si—Si
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三第一次月考化学试卷(解析版) 题型:选择题
(原创)下列有关实验数据处理,正确的是
A.用pH试纸测得新制氯水的pH为2
B.中和滴定实验中,滴定管内液面对应的刻度由0 mL变为10 mL
C.某同学在托盘天平左盘放置5g砝码,游码位于0.5g处,则所得药品质量为5.5g
D.质量分数为20%的NaCl溶液与水等质量混合,稀释后溶液的质量分数必为10%
查看答案和解析>>
科目:高中化学 来源:2016届宁夏回族自治区银川一中高三上学期第一次月考化学试卷(解析版) 题型:填空题
(14分)氮是一种重要的非金属元素,可以形成多种不同类型的化合物,请根据要求回答 下列问题:
下列问题:
(1)NA表示阿伏加德罗常数的数值。69g NO2和N2O4的混合气体中含有____NA个氧原子;2L 0.6 mol/LFe(NO3)3溶液中含_____NA个NO3-离子。
(2)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,
① 写出该反应的化学方程式 .
若反应中生成0.15 mol HNO3,转移的电子数目为________个.
② 三氟化氮可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F;据题意推测 NF3、F2、NO三种气体中,氧化性由强到弱的顺序为
③NF3是一种无色、无臭的气体,一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有_______________(填化学式).
(3)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期12月月考化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.质子数为53、中子数为78的碘原子:13153I
B.硫离子的结构示意图: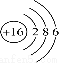
C.H2O2的结构式:H—O—H—O
D.NH4I的电子式: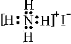
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com