
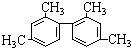
 的烃的下列说法不正确的是( )
的烃的下列说法不正确的是( )| A. | 分子式为C16H18 | |
| B. | 分子中至少有11个碳原子处于同一平面上 | |
| C. | 属于苯的同系物 | |
| D. | 一氯代物存在5种同分异构体 |
分析 该物质含2个苯环,碳碳单键可以绕键轴旋转,则2个苯环可能不在同一平面内,以此来解答.
解答 解:A.由结构简式可知分子式为C16H18,故A正确;
B.甲基与苯环平面结构通过单键相连,甲基的C原子处于苯的H原子位置,所以处于苯环这个平面.两个苯环相连,与苯环相连的碳原子处于另一个苯的H原子位置,也处于另一个苯环这个平面.如图所示 的甲基碳原子、甲基与苯环相连的碳原子、苯环与苯环相连的碳原子,处于一条直线,所以至少有11个碳原子共面,故B正确;
的甲基碳原子、甲基与苯环相连的碳原子、苯环与苯环相连的碳原子,处于一条直线,所以至少有11个碳原子共面,故B正确;
C.含有2个苯环,则与苯的结构不同,不是同系物,故C错误;
D.由结构的对称性可知,含3种位置的H,且甲基有2种,共5种,故D正确.
故选C.
点评 本题考查有机物的结构与性质,注意把握结构中苯环的平面结构是解答的关键,明确结构的对称性分析H,注重基础知识的考查,题目难度不大.


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:选择题
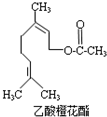 乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( )| A. | ①②③ | B. | ①②⑤ | C. | ②④⑥ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将废电池深埋,可防止重金属污染 | |
| B. | 所有需要加热的化学反应都是吸热反应 | |
| C. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 | |
| D. | 开发利用可燃冰是缓解能源紧缺的唯一途径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①④⑥ | C. | ②③⑤ | D. | ②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.
水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si投入NaOH溶液中 Si+2OH-═SiO32-+H2 | |
| B. | 把 Al中投入到少量氢氧化钠溶液 Al3++3OH-═Al(OH)3↓ | |
| C. | 向明矾溶液中加入氢氧化钡溶液,恰好使“SO42-”完全沉淀 Al3++2SO42-+2Ba2++3OH-═2BaSO4↓+Al(OH)3↓ | |
| D. | Na[Al(OH)4]溶液中加入过量CO2[Al(OH)4]-+CO2═HCO3-+Al(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com