
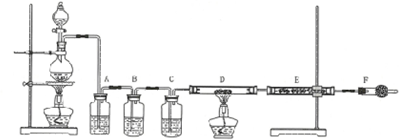
 过量的锌与浓硫酸作用的全过程中产生的气体可能有多种.有人认为气体中可能有SO2,也可能有H2.为了说明这两种气体的有无,设计了如图所示的实验装置.
过量的锌与浓硫酸作用的全过程中产生的气体可能有多种.有人认为气体中可能有SO2,也可能有H2.为了说明这两种气体的有无,设计了如图所示的实验装置.分析 浓硫酸具有强氧化性,金属锌具有还原性,Zn与浓H2SO4反应生成硫酸锌、二氧化硫和水,反应的方程式为:Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O,随反应进行,浓硫酸变为稀硫酸,Zn与稀硫酸反应生成硫酸锌与氢气.装置A的作用为检验气体X中有二氧化硫,通常使用品红溶液;酸性高锰酸钾溶液除去二氧化硫,B装置吸收水蒸气,C用于干燥气体,D中氢气与CuO发生置换反应,E中硫酸铜吸水,根据D固体颜色变化或E中硫酸铜颜色变化,判断是否有氢气生成,F中可以盛放碱石灰,防止空气中水蒸气加入E中,以此解答该题.
解答 解:浓硫酸具有强氧化性,金属锌具有还原性,Zn与浓H2SO4反应生成硫酸锌、二氧化硫和水,反应的方程式为:Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O,随反应进行,浓硫酸变为稀硫酸,Zn与稀硫酸反应生成硫酸锌与氢气.装置A的作用为检验气体X中有二氧化硫,通常使用品红溶液;酸性高锰酸钾溶液除去二氧化硫,B装置吸收水蒸气,C用于干燥气体,D中氢气与CuO发生置换反应,E中硫酸铜吸水,根据D固体颜色变化或E中硫酸铜颜色变化,判断是否有氢气生成,F中可以盛放碱石灰,防止空气中水蒸气加入E中,
(1)因反应有气体生成,实验时应先检查气密性,防止实验失败,故答案为:检验装置的气密性;
(2)由以上分析可知A中药品为品红溶液,B中药品为KMnO4溶液,C中药品为浓硫酸,D中药品为氧化铜,E中药品为无水硫酸铜,F中药品为碱石灰,
故答案为:e;f;a;d;c;g;
(3)如由二氧化硫生成,则A中品红溶液颜色褪去,故答案为:A;品红溶液颜色褪去;
(4)开始时硫酸浓度较大,与锌反应生成二氧化硫气体,随着反应的进行,硫酸浓度减小,则到后期时生成氢气,可在D装置中观察到黑色固体变红,E中白色固体变蓝色,
故答案为:反应后期;DE;D装置中观察到黑色固体变红,E中白色固体变蓝色;随着反应的进行硫酸变稀,与锌反应生成氢气;
(5)仪器C中放入试剂为浓硫酸,作用是干燥进入CuO的氢气,否则不能说明使无水硫酸铜变蓝的水是氢气还原氧化铜而来,且损坏硬质玻璃管E,
故答案为:干燥进入CuO的氢气;干燥进入CuO的氢气,否则不能说明使无水硫酸铜变蓝的水是氢气还原氧化铜而来,且损坏硬质玻璃管E;
(6)碱石灰的主要成分为氧化钙和氢氧化钠,能吸收水和二氧化碳,为防止空气中的水蒸气进入E中而干扰实验现象,
故答案为:防止空气中的水蒸气进入E中.
点评 本题考查锌和硫酸的反应及产物的检验,题目难度中等,注意掌握浓硫酸的性质,根据需检验气体的性质、检验方法理解检验的先后顺序是解答的关键.


科目:高中化学 来源: 题型:实验题
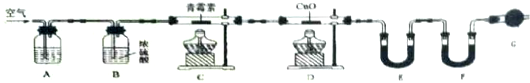
| 装置 | 实验前/g | 实验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 并不是所有物质都含有化学键 | B. | 只有非金属原子间才能形成共价键 | ||
| C. | 单质不可能含有离子键 | D. | 共价化合物中不可能含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据下列图示变化及已知条件填空.
根据下列图示变化及已知条件填空.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
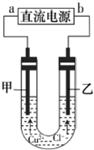
| A. | b端是直流电源的负极 | |
| B. | 用湿润的KI一淀粉试纸检验甲电极产物 | |
| C. | 通电一段时间后,在阴极附近观察到黄绿色气体 | |
| D. | 若将甲电极换成铁棒,乙电极换成铜棒,则可实现在铁棒上镀铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
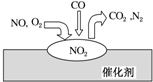 在汽车尾气净化装置里,气体在催化剂表面吸附与释放的过程如图所示.下列说法正确的是( )
在汽车尾气净化装置里,气体在催化剂表面吸附与释放的过程如图所示.下列说法正确的是( )| A. | NO是该过程的中间产物 | |
| B. | NO和O2必须在催化剂表面才能反应 | |
| C. | 汽车尾气的主要污染成分包括CO2和NO | |
| D. | 汽车尾气的主要污染物是CO和NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N5+离子中含有36个电子 | B. | O2与O4属于同位素 | ||
| C. | C60比金刚石熔点高 | D. | H2与H3属于同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .乙烯与溴水的反应是加成反应.把甲烷和氯气混合在一起的试管倒置在装有饱和食盐水的水槽中进行光照有几种产物5种,最多的是氯化氢.
.乙烯与溴水的反应是加成反应.把甲烷和氯气混合在一起的试管倒置在装有饱和食盐水的水槽中进行光照有几种产物5种,最多的是氯化氢.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com