
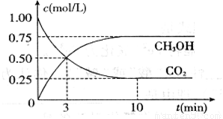
£Ø12·Ö£©ĪŖ¼õČõĪĀŹŅŠ§Ó¦£¬³żĮĖ¼õÉŁCO2µÄÅÅ·Å”¢Ö²Ź÷ŌģĮÖ”¢½«ŅŗĢ¬CO2×¢ČėÉīŗ£µČ“ėŹ©Ķā£¬»¹ÓŠŅ»ÖÖĖ¼Ā·ŹĒ½«CO2×Ŗ»Æ³ÉĘäĖüæÉČ¼ĪļÖŹ”£Čē¹¤ŅµÉĻŅŃŹµĻÖCO2ŗĶH2·“Ӧɜ³É¼×“¼µÄ×Ŗ»Æ”£ŅŃÖŖ£ŗŌŚŅ»ŗćĪĀ”¢ŗćČŻĆܱÕČŻĘ÷ÖŠ³äČėl mol CO2ŗĶ3mol H2£¬Ņ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗCO2(g)+3H2(g) £½CH3OH (g)+H2O(g) ”÷H= £49.0 kJ£Æmol£¬²āµĆCO2ŗĶCH3OH(g)µÄÅضČĖꏱ¼ä±ä»ÆČēĻĀĶ¼ĖłŹ¾”£Ēė»Ų“š£ŗ
(1)“ļµ½Ę½ŗāµÄŹ±æĢŹĒ____________min(Ģī”°3”±»ņ”°10”±)”£ŌŚĒ°10minÄŚ£¬ÓĆCO2±ķŹ¾µÄ·“Ó¦ĖŁĀŹ![]() (CO2)=________
(CO2)=________
(2)ÄÜÅŠ¶ĻøĆ·“Ó¦“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŅĄ¾ŻŹĒ ”£
a£®ČŻĘ÷Ń¹Ēæ²»±ä b£®»ģŗĻĘųĢåÖŠc(CO2)²»±ä
c£®![]() (CH3OH)=
(CH3OH)= ![]() (H2O) d£®c(CH3OH)=c(H2O)
(H2O) d£®c(CH3OH)=c(H2O)
(3)ĪŖĮĖĢįøßH2µÄ×Ŗ»ÆĀŹ£¬æɲÉČ”__________(Ģī”°Ōö“ó”±»ņ”°¼õŠ””±)CO2ÅØ¶ČµÄ“ėŹ©”£
(4)“ļĘ½ŗāŗó£¬H2µÄ×Ŗ»ÆĀŹŹĒ_____________”£Ę½ŗā³£ŹżK=____________”£(¼ĘĖć½į¹ū±£ĮōŅ»Ī»Š”Źż)

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2011-2012ѧğŗžÄĻŹ”ŗāŃō°ĖÖŠø߶žµŚ¶ž“ĪŌĀæ¼»ÆѧŹŌ¾ķ ĢāŠĶ£ŗĢīæÕĢā
£Ø12·Ö£©ĪŖ¼õČõĪĀŹŅŠ§Ó¦£¬³żĮĖ¼õÉŁCO2µÄÅÅ·Å”¢Ö²Ź÷ŌģĮÖ”¢½«ŅŗĢ¬CO2×¢ČėÉīŗ£µČ“ėŹ©Ķā£¬»¹ÓŠŅ»ÖÖĖ¼Ā·ŹĒ½«CO2×Ŗ»Æ³ÉĘäĖüæÉČ¼ĪļÖŹ”£Čē¹¤ŅµÉĻŅŃŹµĻÖCO2ŗĶH2·“Ӧɜ³É¼×“¼µÄ×Ŗ»Æ”£ŅŃÖŖ£ŗŌŚŅ»ŗćĪĀ”¢ŗćČŻĆܱÕČŻĘ÷ÖŠ³äČėl mol CO2ŗĶ3mol H2£¬Ņ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗCO2(g)+3H2(g) £½CH3OH(g)+H2O(g)


 ”÷H= £49.0 kJ£Æmol£¬²āµĆCO2ŗĶCH3OH(g)µÄÅضČĖꏱ¼ä±ä»ÆČēĻĀĶ¼ĖłŹ¾”£Ēė»Ų“š
”÷H= £49.0 kJ£Æmol£¬²āµĆCO2ŗĶCH3OH(g)µÄÅضČĖꏱ¼ä±ä»ÆČēĻĀĶ¼ĖłŹ¾”£Ēė»Ų“š £ŗ
£ŗ
(1)“ļµ½Ę½ŗāµÄŹ±æĢŹĒ____________min(Ģī”°3”±»ņ”°10”±)”£ ŌŚĒ°10minÄŚ£¬ÓĆCO2±ķŹ¾µÄ·“Ó¦ĖŁĀŹ
ŌŚĒ°10minÄŚ£¬ÓĆCO2±ķŹ¾µÄ·“Ó¦ĖŁĀŹ (CO2)="________"
(CO2)="________"
(2)ÄÜÅŠ¶ĻøĆ·“Ó¦“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŅĄ¾ŻŹĒ ”£ a£®ČŻĘ÷Ń¹Ēæ²»±ä b£®»ģŗĻĘųĢåÖŠc(CO2)²»±ä
a£®ČŻĘ÷Ń¹Ēæ²»±ä b£®»ģŗĻĘųĢåÖŠc(CO2)²»±ä
c£® (CH3OH)=
(CH3OH)=  (H2O) d£®c(CH3
(H2O) d£®c(CH3 OH)=c(H2O)
OH)=c(H2O) (3)ĪŖĮĖĢįøßH2µÄ×Ŗ»ÆĀŹ£¬æɲÉČ”__________(Ģī”°Ōö“ó”±»ņ”°¼õŠ””±)CO2ÅØ¶ČµÄ“ėŹ©”£
(3)ĪŖĮĖĢįøßH2µÄ×Ŗ»ÆĀŹ£¬æɲÉČ”__________(Ģī”°Ōö“ó”±»ņ”°¼õŠ””±)CO2ÅØ¶ČµÄ“ėŹ©”£
(4)“ļĘ½ŗāŗó£¬H2µÄ×Ŗ»ÆĀŹŹĒ_____________”£Ę½ŗā³£ŹżK=____________”£(¼ĘĖć½į¹ū±£ĮōŅ»Ī»Š”Źż)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013½ģŗžÄĻŹ”ø߶žµŚ¶ž“ĪŌĀæ¼»ÆѧŹŌ¾ķ ĢāŠĶ£ŗĢīæÕĢā
£Ø12·Ö£©
ĪŖ¼õČõĪĀŹŅŠ§Ó¦£¬³żĮĖ¼õÉŁCO2µÄÅÅ·Å”¢Ö²Ź÷ŌģĮÖ”¢½«ŅŗĢ¬CO2×¢ČėÉīŗ£µČ“ėŹ©Ķā£¬»¹ÓŠŅ»ÖÖĖ¼Ā·ŹĒ½«CO2×Ŗ»Æ³ÉĘäĖüæÉČ¼ĪļÖŹ”£Čē¹¤ŅµÉĻŅŃŹµĻÖCO2ŗĶH2·“Ӧɜ³É¼×“¼µÄ×Ŗ»Æ”£ŅŃÖŖ£ŗŌŚŅ»ŗćĪĀ”¢ŗćČŻĆܱÕČŻĘ÷ÖŠ³äČėl mol CO2ŗĶ3mol H2£¬Ņ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗCO2(g)+3H2(g) £½CH3OH (g)+H2O(g)
 ”÷H= £49.0 kJ£Æmol£¬²āµĆCO2ŗĶCH3OH(g)µÄÅضČĖꏱ¼ä±ä»ÆČēĻĀĶ¼ĖłŹ¾”£Ēė»Ų“š£ŗ
”÷H= £49.0 kJ£Æmol£¬²āµĆCO2ŗĶCH3OH(g)µÄÅضČĖꏱ¼ä±ä»ÆČēĻĀĶ¼ĖłŹ¾”£Ēė»Ų“š£ŗ
(1)“ļµ½Ę½ŗāµÄŹ±æĢŹĒ____________min(Ģī”°3”±»ņ”°10”±)”£ ŌŚĒ°10minÄŚ£¬ÓĆCO2±ķŹ¾µÄ·“Ó¦ĖŁĀŹ
ŌŚĒ°10minÄŚ£¬ÓĆCO2±ķŹ¾µÄ·“Ó¦ĖŁĀŹ (CO2)=________
(CO2)=________
(2)ÄÜÅŠ¶ĻøĆ·“Ó¦“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŅĄ¾ŻŹĒ ”£
a£®ČŻĘ÷Ń¹Ēæ²»±ä b£®»ģŗĻĘųĢåÖŠc(CO2)²»±ä
c£® (CH3OH)=
(CH3OH)=  (H2O)
d£®c(CH3OH)=c(H2O)
(H2O)
d£®c(CH3OH)=c(H2O)
 (3)ĪŖĮĖĢįøßH2µÄ×Ŗ»ÆĀŹ£¬æɲÉČ”__________(Ģī”°Ōö“ó”±»ņ”°¼õŠ””±)CO2ÅØ¶ČµÄ“ėŹ©”£
(3)ĪŖĮĖĢįøßH2µÄ×Ŗ»ÆĀŹ£¬æɲÉČ”__________(Ģī”°Ōö“ó”±»ņ”°¼õŠ””±)CO2ÅØ¶ČµÄ“ėŹ©”£
(4)“ļĘ½ŗāŗó£¬H2µÄ×Ŗ»ÆĀŹŹĒ_____________”£Ę½ŗā³£ŹżK=____________”£(¼ĘĖć½į¹ū±£ĮōŅ»Ī»Š”Źż)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĪŖ¼õČõĪĀŹŅŠ§Ó¦£¬³żĮĖ¼õÉŁCO2µÄÅÅ·Å”¢Ö²Ź÷ŌģĮÖ”¢½«ŅŗĢ¬CO2×¢ČėÉīŗ£µČ“ėŹ©Ķā£¬»¹ÓŠŅ»ÖÖĖ¼Ā·ŹĒ½«CO2×Ŗ»Æ³ÉĘäĖüæÉČ¼ĪļÖŹ”£Čē¹¤ŅµÉĻŅŃŹµĻÖCO2ŗĶH2·“Ӧɜ³É¼×“¼µÄ×Ŗ»Æ”£ŅŃÖŖ£ŗŌŚŅ»ŗćĪĀ”¢ŗćČŻĆܱÕČŻĘ÷ÖŠ³äČėl mol CO2ŗĶ3mol H2£¬Ņ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗCO2(g)+3H2(g) £½CH3OH (g)+H2O(g)![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ”÷H= £49.0 kJ£Æmol£¬²āµĆCO2ŗĶCH3OH(g)µÄÅضČĖꏱ¼ä±ä»ÆČēĻĀĶ¼ĖłŹ¾”£
”÷H= £49.0 kJ£Æmol£¬²āµĆCO2ŗĶCH3OH(g)µÄÅضČĖꏱ¼ä±ä»ÆČēĻĀĶ¼ĖłŹ¾”£![]() Ēė»Ų“š
Ēė»Ų“š![]()
![]() £ŗ
£ŗ
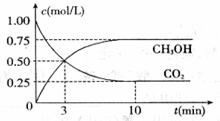
(1)“ļµ½Ę½ŗāµÄŹ±æĢŹĒ____________min(Ģī”°3”±»ņ”°10”±)”£
![]() ŌŚĒ°10minÄŚ£¬ÓĆCO2±ķŹ¾µÄ·“Ó¦ĖŁĀŹ
ŌŚĒ°10minÄŚ£¬ÓĆCO2±ķŹ¾µÄ·“Ó¦ĖŁĀŹ![]() (CO2)=________
(CO2)=________
![]() (2)ÄÜÅŠ¶ĻøĆ·“Ó¦“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŅĄ¾ŻŹĒ ”£
(2)ÄÜÅŠ¶ĻøĆ·“Ó¦“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŅĄ¾ŻŹĒ ”£
![]() a£®ČŻĘ÷Ń¹Ēæ²»±ä b£®»ģŗĻĘųĢåÖŠc(CO2)²»±ä
a£®ČŻĘ÷Ń¹Ēæ²»±ä b£®»ģŗĻĘųĢåÖŠc(CO2)²»±ä
![]() c£®
c£®![]() (CH3OH)=
(CH3OH)= ![]() (H2O) d£®c(CH3OH)=c(H2O)
(H2O) d£®c(CH3OH)=c(H2O)
![]() (3)ĪŖĮĖĢįøßH2µÄ×Ŗ»ÆĀŹ£¬æɲÉČ”__________(Ģī”°Ōö“ó”±»ņ”°¼õŠ””±)CO2ÅØ¶ČµÄ“ėŹ©”£
(3)ĪŖĮĖĢįøßH2µÄ×Ŗ»ÆĀŹ£¬æɲÉČ”__________(Ģī”°Ōö“ó”±»ņ”°¼õŠ””±)CO2ÅØ¶ČµÄ“ėŹ©”£
(4)“ļĘ½ŗāŗó£¬H2µÄ×Ŗ»ÆĀŹŹĒ_____________”£Ę½ŗā³£ŹżK=____________”£(¼ĘĖć½į¹ū±£ĮōŅ»Ī»Š”Źż)
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com