
【题目】已知烃A的分子式为C6H12,分子中含有碳碳双键,且仅有一种类型的氢原子,在下面的转化关系中,D1、D2互为同分异构体,E1、E2互为同分异构体。

(1)反应②的化学方程式为
___________________________________________________________;
(2)C的化学名称是_____________________________;E2的结构简式是_______________________;
(3)④、⑥的反应类型依次是_________________________、__________________________
【答案】 +2NaOH
+2NaOH![]()
![]() +2NaCl+2H2O; 2,3-二甲基-1,3-丁二烯
+2NaCl+2H2O; 2,3-二甲基-1,3-丁二烯 ![]() 1,4-加成反应 取代反应
1,4-加成反应 取代反应
【解析】
烃分子式为C6H12,只含有一个碳碳双键且只有一种类型的氢原子的结构简式为![]() ;A(
;A(![]() )与氯气加成生成B(
)与氯气加成生成B( );B强碱醇溶液作用下发生消去反应生成C(
);B强碱醇溶液作用下发生消去反应生成C(![]() );C与溴的四氯化碳溶液1,2-加成生成D1(
);C与溴的四氯化碳溶液1,2-加成生成D1( ),D1强碱溶溶液作用下水解生成E1(
),D1强碱溶溶液作用下水解生成E1( );C与溴的四氯化碳溶液1,4-加成生成D2(
);C与溴的四氯化碳溶液1,4-加成生成D2(![]() );D2强碱溶溶液作用下水解生成E2(
);D2强碱溶溶液作用下水解生成E2(![]() )。
)。
(1)根据以上分析可知反应②是B( )强碱醇溶液作用下发生消去反应生成C(
)强碱醇溶液作用下发生消去反应生成C(![]() ),化学方程式为:
),化学方程式为: +2NaOH
+2NaOH![]()
![]() +2NaCl+2H2O;
+2NaCl+2H2O;
答案: +2NaOH
+2NaOH![]()
![]() +2NaCl+2H2O;
+2NaCl+2H2O;
(2)C为![]() ,化学名称为:2,3-二甲基-1,3-丁二烯;由上述分析可知,E2的结构简式是
,化学名称为:2,3-二甲基-1,3-丁二烯;由上述分析可知,E2的结构简式是![]() ;
;
答案:2,3-二甲基-1,3-丁二烯 ![]()
(3)反应④是二烯烃发生的1,4-加成反应,反应⑥是卤代烃的分解反应,属于取代反应;
答案:1,4-加成反应 取代反应


科目:高中化学 来源: 题型:
【题目】下列有关工业生产的叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸厂靠近原料产地比靠近硫酸消费中心更为有利
C.由于2SO2(g)+O2(g)![]() 2SO3(g),所以硫酸生产中常采用高压条件提高SO2的转化率
2SO3(g),所以硫酸生产中常采用高压条件提高SO2的转化率
D.充分利用硫酸厂生产过程中产生的“废热”,可使硫酸厂向外界输出大量的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化合物的同分异构体数目判断正确的是( )
A. 分子式为C5H10,含碳碳双键的烯烃为6种
B. 分子式为C8H10,含苯环的有机物为3种
C. 分子式为C5H12O,且能与Na反应的有机物为8种
D. 分子式为C5H10O2,且能与Na2CO3反应的有机物为10种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雷美替胺是首个没有列为特殊管制的非成瘾失眠症治疗药物,合成该有机物过程中涉及如下转化,下列说法不正确的是( )
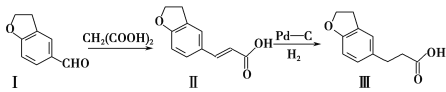
A.溴水无法区分化合物I和化合物Ⅱ
B.化合物Ⅰ、Ⅱ、Ⅲ均能与NaHCO3溶液发生反应
C.1 mol化合物Ⅲ最多能与3 mol H2发生加成反应
D.化合物Ⅰ、Ⅱ、Ⅲ分子中不存在手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+3H2O
B.向NaAlO2溶液中加入NaHCO3溶液:HCO3-+AlO2-+H2O=CO2↑+Al(OH)3↓
C.铁电极电解饱和食盐水:Fe+2H2O![]() Fe(OH)2↓+H2↑
Fe(OH)2↓+H2↑
D.向Ca(ClO)2溶液中通入过量的CO2气体:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在国民经济发展中起着重要作用。
(1)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜锈的主要成分为Cu2(OH)2CO3(碱式碳酸铜)。该过程中负极的电极反应式为_________。
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示:

①根据下表数据,请你判断该电池工作的适宜温度应控制在_________。
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2 050 |
沸点/℃ | 892 | 444.6 | 2 980 |
a.100 ℃以下 b.100 ℃~300 ℃
c.300 ℃~350 ℃ d.350 ℃~2 050 ℃
②放电时,电极A为_________极,S发生_________反应。
③放电时,内电路中Na+的移动方向为_________(填写“从A到B”或“从B到A”)。
④充电时,总反应为Na2Sx=2Na+Sx(3<x<5),Na所在电极与直流电源_________极相连,阳极的电极反应式________。
(3)某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。

①正极反应为_________。
②当电路中转移0.005 mol e-时,交换膜左侧溶液中约减少_________mol离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有机化学家发展了一些新型的有机试剂,如氟化试剂CpFluor-2,其与醇反应可以高产率、高选择性地生成氟代物。
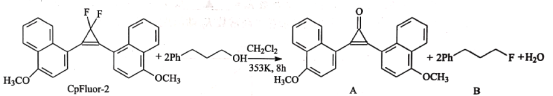
下列有关说法正确的是( )
A.该过程中只发生了取代反应B.CpFluor-2苯环上的一氯代物有3种
C.CH2Cl2能跟氢氧化钠醇溶液发生消去反应D.A中的官能团有醚键、羰基和碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3和CO2是两种重要的化工原料。
(1)在一定温度下,在固定体积的密闭容器中发生反应:N2+3H22NH3。该可逆反应达到化学平衡的标志是_________(填字母)。
a.3v(H2)正=2v(NH3)逆
b.单位时间生成m mol N2的同时消耗3m mol H2
c.混合气体的密度不再随时间变化
d.a molN≡N键断裂的同时,有6a mol N-H键断裂
(2)最近科学家们研制成功一种新型催化剂,能将CO2转变为甲烷。在常压、300 ℃,CO2与H2体积比为1∶4时反应,CO2转化率达90%。
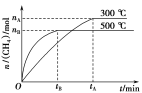
①此反应的化学方程式是_________。
②一定条件下,某兴趣小组,在体积为V L的密闭容器中,模拟此反应达到化学平衡状态。该反应的平衡常数表达式为_________;由上图可知升高温度,K将_________(填“增大”、“减小”或“不变”);300 ℃时,从反应开始,到达到平衡,以H2的浓度变化表示的化学反应速率是_________(用nA、tA、V表示)。
(3)一氧化碳能还原金属氧化物生成金属单质和二氧化碳。下图是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时lgc(CO)/c(CO2)与温度(T)的关系图。
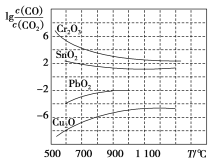
800 ℃时,四种金属氧化物中最易被一氧化碳还原的金属氧化物与CO反应的化学方程式为_________,该反应的平衡常数K=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图容器底部是培养基,其中含有植物生长所需的全部养分,如果有人在配制培养基的矿质元素中使用了NH4NO3、KNO3、CaCl2·2H2O、MgSO4·7H2O、螯合铁溶液、微量元素溶液,但缺少了一种必需元素,为补充这种元素,应添加的化合物是( )

A.Ca(NO3)2B.KClC.KH2PO4D.K2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com