
【题目】向X的溶液中加入Y试剂,产生的沉淀示意图与下图所示情形吻合的是(注意线段的斜率)
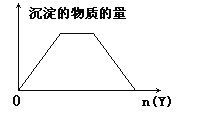
A.向NaOH和Ca(OH)2的混合溶液中通入CO2B.向HCl和AlCl3的混合溶液中滴加NaOH
C.向NH4Al(SO4)2溶液中滴加NaOHD.向NH4Cl和MgCl2的混合溶液中滴加NaOH
【答案】A
【解析】
A.NaOH、Ca(OH)2都是碱,CO2与OH-反应生成CO32-,随着发生Ca2++CO32-=CaCO3↓,因此认为,反应先后顺序是:Ca(OH)2+CO2=CaCO3↓+H2O、NaOH+CO2=NaHCO3、CaCO3+CO2+H2O=Ca(HCO3)2,符合题中图像,故A正确;
B.盐酸是酸,先于NaOH反应,因此顺序是HCl+NaOH=NaCl+H2O,Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,开始一段时间无沉淀,然后出现沉淀,最后沉淀完全消失,与图像不符,故B错误;
C.Al3+结合OH-能力强于NH4+,反应先后顺序是:Al3++3OH-=Al(OH)3↓、NH4++OH-=NH3·H2O、Al(OH)3+OH-=AlO2-+2H2O,生成沉淀最大消耗NaOH的量是Al(OH)3完全消失消耗NaOH量的3倍,与图像不符,故C错误;
D.Mg2+结合OH-能力强于NH4+,因此有Mg2++2OH-=Mg(OH)2↓、NH4++OH-=NH3·H2O,与图像不符,故D错误。
故选A。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:
【题目】已知2NaHCO3![]() Na2CO3 + H2O+CO2 ,现把14.8g Na2CO310H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中c(Na+)=1.2molL﹣1,若把等质量的固体混合物加热至恒重,残留固体质量是( )
Na2CO3 + H2O+CO2 ,现把14.8g Na2CO310H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中c(Na+)=1.2molL﹣1,若把等质量的固体混合物加热至恒重,残留固体质量是( )
A. 6.36gB. 3.18gC. 4.22gD. 5.28g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能用勒夏特列原理解释的是
A. 钢铁在潮湿的空气中容易生锈
B. 棕红色NO2加压后颜色先变深后变浅
C. 高温及加入催化剂都能使合成氨的反应速率加快
D. H2、I2、HI平衡混合气加压后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应是氧化还原反应的是( )
A.AgNO3 + HCl ==AgCl↓+ HNO3
B.NH4HCO3 ![]() NH3↑+ CO2↑+ H2O
NH3↑+ CO2↑+ H2O
C.2KClO3 ![]() 2KCl+3O2↑
2KCl+3O2↑
D.CaO+H2O ==Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.电离平衡常数是衡量弱电解质电离程度的量,已知如表数据(25℃):
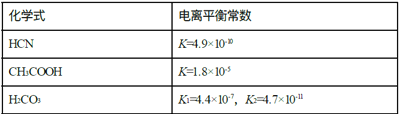
(1)25℃时,下列物质的量浓度相同的四种溶液的pH由大到小的顺序为_____(填序号)
a NaCN溶液 b Na2CO3溶液 c CH3COONa溶液 d NaHCO3溶液
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为____________。
Ⅱ.根据下列化合物:①NaOH ②H2SO4 ③CH3COOH ④NaCl ⑤CH3COONa ⑥(NH4)2SO4 ⑦CH3COONH4 ⑧NH4HSO4 ⑨NH3H2O ⑩NH4Cl,请回答下列问题:
(1)常温下,若pH均为11且等体积的NaOH和NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则m_______n(填“<”、“>”或“=”)。
(2)已知水存在如下平衡:H2O![]() H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是____________。
H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是____________。
A 向水中加入NaHSO4固体 B 向水中加NaHCO3固体
C 加热至100℃[其中c(H+)=1×10-6 mol·L-1] D 向水中加入NH4Cl固体
(3)物质的量浓度相同的①、②、③、④、⑤、⑥六种稀溶液中,水电离的OH-浓度由大到小的顺序为(填序号)__________。
(4)物质的量浓度相同的⑥、⑦、⑧、⑨、⑩五种稀溶液中,NH4+浓度由大到小的顺序是(填序号)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,CH3COOH的电离平衡常数为1.7×10-5。
(1)CH3COOH的电离方程式为_________。25℃,0.1mol/LCH3COOH溶液中计算c(H+)的表达式为__________。
(2)25℃时,CH3COONa稀溶液中的水解平衡常数等于_____ (保留小数点后一位数字)。
(3)25℃,0.1 mol/LCH3COONa溶液的pH最接近______(填选项)。
A.9 B.10 C.11 D.12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准),则下列有关说法正确的是( )

A.湿润的蓝色石蕊试纸先变红后褪色
B.湿润的品红试纸褪色,证明SO2具有漂白性
C.湿润的淀粉-KI试纸未变蓝,说明SO2的氧化性强于I2
D.蘸有酸性KMnO4溶液的滤纸褪色,证明SO2具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。
水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
![]()
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:_____________。
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水中溶解氧量,消耗0.01000 mol·L1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(以mg·L1表示),写出计算过程_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用如图装置制得氯气并与铝粉反应制备无水AlCl3。已知AlCl3在183°C升华,遇潮湿空气即反应产生大量白雾。请回答问题:
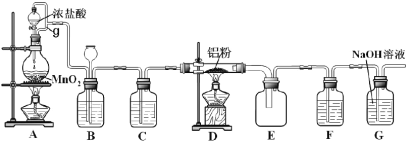
(1)A中反应的化学方程式为_________;HCl在反应中表现出的性质为______(填:酸性、氧化性或还原性)。
(2)A中g管的作用是________。
(3)B中盛放饱和食盐水的作用是________;若D中生成的AlCl3凝华堵塞导管,B中可观察到的现象为________。
(4)C和F所装试剂相同,其中F的作用是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com