

分析 (1)Fe3+将SO2氧化成SO42-的,铁离子被还原生成亚铁离子,结合电荷守恒和原子守恒配平书写离子方程式;
(2)二氧化硫是酸性氧化物,溶于水生成亚硫酸显酸性,石蕊试液变红色,氯气具有氧化性能氧化二氧化硫生成硫酸,溶液红色褪去;
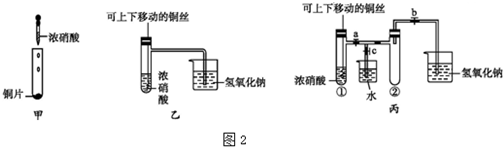
(3)①铜与浓硝酸的反应生成二氧化氮和硝酸铜,硝酸中氮元素化合价+5价变化为+4价做氧化剂,同时生成硝酸铜表现硝酸的酸性,往浅绿色的Fe(NO3)2溶液中,逐滴加入稀盐酸时,溶液中氢离子和硝酸根离子形成稀硝酸具有氧化性能氧化亚铁离子为铁离子,溶液颜色浅绿色变化为黄色;
②根据甲乙两个装置的不同点分析;
(4)图3中装置是氨气的喷泉实验,浓氨水易挥发,挥发出的氨气分子和浓盐酸挥发出的氯化氢分子结合生成白色烟氯化铵固体小颗粒.
解答 解:(1)Fe3+将SO2氧化成SO42-的,铁离子被还原生成亚铁离子,反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(2)二氧化硫是酸性氧化物,溶于水生成亚硫酸显酸性,遇到石蕊试液变红色,向滴有紫色石蕊溶液的试管中通入SO2气体,现象是紫色石蕊溶液变红,若再向其中滴入足量的氯水,氯气具有氧化性能氧化二氧化硫生成硫酸,现象是溶液红色褪去,过程中发生反应的化学方程式为:Cl2+SO2+2H2O=2HCl+H2SO4; Cl2+H2O=HCl+HClO,
故答案为:紫色石蕊溶液变红;变红的溶液逐渐褪色;Cl2+SO2+2H2O=2HCl+H2SO4; Cl2+H2O=HCl+HClO;
(3)①甲、乙、丙三个装置中共同的一个反应是浓硝酸与铜片反应或是浓硝酸与铜丝反应,即Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,在硝酸的作用为显示了酸性和强氧化性,往浅绿色的Fe(NO3)2溶液中,逐滴加入稀盐酸时,氢离子和硝酸根离子形成硝酸具有强氧化性,能氧化亚铁离子为铁离子,溶液的颜色变化应是溶液颜色变黄加深
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;酸性、强氧化性;溶液颜色变黄加深;
②甲、乙两个装置的差异在于:甲装置铜与浓硝酸反应使用的是铜片直接与浓硝酸反应,而乙装置则是可移动的铜丝与浓硝酸反应,其优点为便于控制,需要时插入酸液就反应,不需要时从酸液中移出即可;甲装置没有处理NO2污染的装置,而乙装置用氢氧化钠溶液吸收产生的NO2,能防止空气污染.
故答案为:可以控制反应;吸收NO2气体,防止污染环境;
(4)图3中装置是氨气的喷泉实验,浓氨水易挥发,挥发出的氨气分子和浓盐酸挥发出的氯化氢分子结合生成白色烟氯化铵固体小颗粒,喷泉实验证明氨气极易溶于水,溶于水形成一水合氨弱碱溶液,滴加酚酞的溶液变红色,证明氨气是碱性气体,发烟实验证明浓氨水易挥发,氨气遇到氯化氢发生反应生成氯化铵,证明氨气是碱性气体,
故答案为:C.
点评 本题把实验知识与浓硝酸的性质、二氧化氮的性质、喷泉实验的发生等结合一起,具有很强的综合性,因而难度中等,需要细心审题,认真分析,侧重于考查学生的实验能力和对基础知识的综合应用能力.


科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、HCO3-、NO3- | B. | K+、Fe3+、NO3-、SCN- | ||
| C. | H+、Cr2O72-、SO42-、K+ | D. | H+、Na+、S2O32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | ------- |
| V (NaOH)mL | 20.0 | 40.0 | 60.0 | 80.0 | 100.0 |
| m(沉淀)/g | 1.29 | 3.09 | 4.89 | 5.4 | 5.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱电解质的电离是一个吸热的过程 | |
| B. | 化学反应中的能量变化不仅仅表现为热量变化 | |
| C. | 反应物的总能量大于生成物的总能量的反应是吸热反应 | |
| D. | 断裂化学键吸收能量,形成化学键放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液 | B. | 溴水 | C. | AgNO3溶液 | D. | 淀粉碘化钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫代硫酸钠溶液中滴加稀硫酸会产生淡黄色沉淀和刺激性气味气体 | |
| B. | 向5mL 0.1mol/L的K2Cr2O7溶液中滴加10滴6mol/L的NaOH溶液后溶液的橙色加深 | |
| C. | 测定中和热时,若用50mL 0.55mo1•L-1的氢氧化钠溶液,分别与50mL 0.50mo1•L-1的盐酸和50mL 0.50mo1•L-1的硫酸充分反应,两次实验测定的中和热是相等的 | |
| D. | KMnO4溶液与草酸溶液反应时褪色速度先慢后快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com