
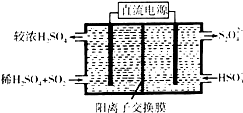
 (1)利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得.NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
(1)利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得.NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
分析 (1)①由表格中的数据可知,HSO3-越多,酸性越强,则电离生成氢离子;吸收液呈中性时,溶质为亚硫酸钠和亚硫酸氢钠,电离与水解的程度相等,结合电荷守恒解答;
②Na2SO3在溶液中存在两步水解,以第一步水解为主;
(2)①阴极上HSO3-得电子生成S2O42-;
②依据在碱性条件下,阴极排出的溶液为S2O42-,二氧化氮与其发生反应生成氮气.
(3)①氨气是碱性气体,可以和酸反应生成盐;
②氨水与SO2恰好完全反应生成正盐,则反应生成亚硫酸铵,根据电离平衡常数判断离子的水解平衡常数,根据水解程度相对大小确定溶液的酸碱性;
③能水解的盐发生水解时促进水的电离.
解答 解:(1)①由表格中的数据可知,溶液呈酸性,HSO3-越多,酸性越强,是因为溶液中存在:HSO3?SO32-+H+; HSO3-+H2O?H2SO3+OH-电离程度大于水解程度,溶液显酸性,
故答案为:酸;溶液中存在:HSO3?SO32-+H+; HSO3-+H2?H2SO3+OH-电离程度大于水解程度,故溶液显酸性;
②Na2SO3在溶液中存在两步水解,以第一步水解为主,SO32-+H2O?HSO3-+OH-,HSO3-+H2O?H2SO3+OH-,则溶液中离子浓度大小的关系为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
故答案为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
(2)①依据图示可知,阴极上HSO3-得电子生成S2O42-,阴极区发生反应2HSO3-+2H++2e-=S2O42-+2H2O;
故答案为:2HSO3-+2H++2e-=S2O42-+2H2O;
②阴极排出的溶液为S2O42-,二氧化氮与其发生反应,S2O42-中硫元素由+3价,变为硫酸根中硫元素为+4价,S2O42-被氧化是还原剂;二氧化氮中的氮元素化合价为+4价变为氮气0价,二氧化氮被还原为氧化剂,依据原子守恒和得失电子守恒可得,发生的离子方程式为4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O,
故答案为:4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O;
(3)①氨气是碱性气体,可以和磷酸反应生成盐,产生的盐随着酸的磷酸的量的多少而不同,可以产生磷酸铵,磷酸氢铵或是磷酸二氢铵,
故答案为:(NH4)3PO4(或(NH4)2HPO4或NH4H2PO4);
②一水合氨的电离平衡常数大于亚硫酸氢根离子的电离 平衡常数,所以铵根离子的水解平衡常数小于亚硫酸根离子水解平衡常数,则亚硫酸根离子水解程度大于铵根离子水解程度,所以溶液呈碱性,
故答案为:碱;
③能水解的盐发生水解时促进水的电离,则当氨水吸收SO2至恰好完全反应形成正盐时,反应过程中生成弱酸弱碱盐,水解促进水的电离,则H2O的电离平衡向右移动;
故答案为:向右.
点评 本题考查弱电解质的电离、盐的水解、离子浓度大小比较、电解原理的分析应用等,比较综合,题目难度中等,侧重于考查学生的分析能力和对基础知识的综合应用能力.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| B. | 硫酸厂按照规定已经处理除去了重金属离子的酸性废水,可直接排放入湖水中 | |
| C. | 现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 | |
| D. | 合金超导材料是指熔合两种或两种以上的金属元素并形成具有超导电性的超导材料,如铌一钛(Nb-Ti)合金,它的熔点一般比纯钛要低 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $→_{△}^{-H_{2}O}$CH3CH=CHCHO
$→_{△}^{-H_{2}O}$CH3CH=CHCHO +CO$→_{△}^{AlCl_{3},HCl}$
+CO$→_{△}^{AlCl_{3},HCl}$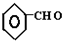

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷与氯气光照反应 | B. | 乙烯与氯气加成反应 | ||
| C. | 乙烯与氢气、氯气混合气体反应 | D. | 乙烯与氯化氢加成反应 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上月考二化学试卷(解析版) 题型:选择题
现有H2S、NH3、CH4三种气体,它们分别都含有相同数目的氢原子,则三种气体的物质的量之比为( )
A. 1∶1∶1 B.2∶3∶4 C.6∶4∶3 D.6∶3∶4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com