
把500 mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀,该混合溶液中钾离子浓度为( )
A.10 (b-2a)mol·L-1 B.5(b-2a)mol·L-1
C.2(b-a)mol·L-1 D.10(2a-b)mol·L-1
科目:高中化学 来源:2017届湖北省高三上学期开学考试化学试卷(解析版) 题型:选择题
下列影响化学反应速率的因素中,是通过改变活化分子百分数来实现的是( )
①改变气体物质的浓度 ②改变气体的压强
③加入催化剂 ④改变气体的温度
A.只有①② B.只有③④ C.只有①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期8月月考化学试卷(解析版) 题型:选择题
下列各组物质,前者是混合物,后者是纯净物的是
A.淀粉与氯化氢 B.钢与浓硫酸
C.纯碱与汽油 D.胆矾与液氯
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三上学期开学测化学试卷(解析版) 题型:填空题
根据氧化还原反应的配平,回答下列问题。
(1)双氧水能使酸性KMnO4溶液褪色,反应式中H2O2的化学计量数为_______________。
(2)KMnO4可与浓盐酸反应制氯气,反应式中HCl的化学计量数为_____________。
(3)单质氯气与强碱溶液共热可生成氯化物和氯酸盐,其离子方程式中OH-离子的化学计量数为______________。
(4)离子方程式(未配平)SnCl2+Cl-+H3AsO3+H+→As+SnCl62-+M(未知物),其中未知物M的化学计量数和化学式分别为________________ 、________________。
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三上学期开学测化学试卷(解析版) 题型:选择题
现将足量的CO2不断通入KOH、Ba(OH)2、NaAlO2的混合溶液中,生成沉淀与通入CO2的量的关系图象正确的是( )

查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第二次月考化学试卷(解析版) 题型:推断题
下图所示各物质是由1~20号元素中部分元素组成的单质或化合物,图中部分反应条件未列出。已知D、L、M为气体单质,C、E、H为气体化合物,反应②、④、⑥是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。
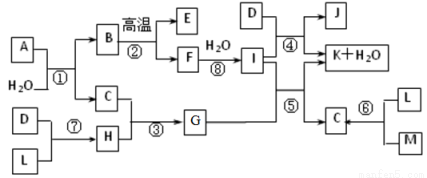
请回答下列问题:
(1)物质E的结构式为 ;
(2)属于化合反应,但不属于氧化还原反应的是 (填写编号);
(3)A由二种元素组成,1molA与水反应可生成1molB和2molC,A的化学式为为 。
(4)化工生产中的重要反应④的离子反应方程式为 ;
(5)检验集气瓶中气体是否为D单质的操作方法是 。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第二次月考化学试卷(解析版) 题型:选择题
向20mL0.05mol·L-1NH4Al(SO4)2溶液中,滴加等物质的量浓度的Ba(OH)2溶液x mL,下列叙述正确的是
A.x=20时,溶液中有NH4+、AlO2-、SO42-,且c(NH4+)>c(SO42-)
B.x=20时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)>c(Al3+)
C.x=60时,溶液中有Ba2+、Al3+、OH-,且c(OH-)=c(Ba2+)
D.x=60时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)<c(AlO2-)
查看答案和解析>>
科目:高中化学 来源:2017届湖北省沙市高三上学期第三次考试化学试卷(解析版) 题型:选择题
在Na+浓度为0.9 mol·L-1的某澄清溶液中,还可能含有下表中的若干种离子:
阳离子 | K+、Ag+、Mg2+、Ba2+ |
阴离子 | NO3―、CO32―、SiO32―、SO42― |
取该溶液100ml进行如下实验(气体体积在标准状况下测定):
I.向该溶液中加入足量稀HCl,产生白色沉淀并放出1.12L气体
II.将I的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称得固体质量为3.6g
III.在II的滤液中滴加BaCl2溶液,无明显现象
下列说法不正确的是
A.K+一定存在,且c(K+)≤1.3mol·L-1
B.实验I能确定一定不存在的离子是Ag+、Mg2+、Ba2+
C.实验I中生成沉淀的离子方程式为SiO32-+2H+=H2SiO3↓
D.实验III能确定一定不存在SO42-
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上学期摸底考试理综化学试卷(解析版) 题型:填空题
Ⅰ.(1)在一密闭容器中一定量A、B的混合气体发生反应:aA(g)+bB(g)  cC(s)+dD(g),平衡时测得A的浓度为0.60 mol/L,保持温度不变,将容器的容积扩大到原来的3倍,再达平衡时,测得A的浓度降为0.20 mol/L。下列有关判断一定正确的是
cC(s)+dD(g),平衡时测得A的浓度为0.60 mol/L,保持温度不变,将容器的容积扩大到原来的3倍,再达平衡时,测得A的浓度降为0.20 mol/L。下列有关判断一定正确的是
A.平衡向正反应方向移动 B.A的转化率增大
C.D的体积分数增大 D.a+b<c+d
(2)①25 ℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
HSO3-的电离平衡常数表达式K=__________________。
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为:_______________。
③根据H2SO3的电离常数数据,判断NaHSO3溶液显酸性还是显碱性?
Ⅱ.0.98 gCu(OH)2样品受热分解的热重曲线(样品质量随温度变化的曲线)如图所示。

请回答下列问题:
(1)试确定1 100 ℃时所得固体B的化学式(要求写出推理或计算过程)。
(2)固体A在一定条件下能与一种能使湿润的红色石蕊试纸变蓝的气体反应,得到红色固体单质和气体单质,则该反应的化学方程式为:____________________;若反应中转移0.015 mol电子,则消耗还原剂的物质的量为________________。
(3)取少量固体B于试管中,加入足量的稀硫酸得到蓝色溶液,同时观察到试管中还有红色固体存在,该反应的离子方程式为:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com