
| A. | 2-甲基-3-乙基戊烷 | B. | 3,4,4-三甲基己烷 | ||
| C. | 2-甲基-4-乙基戊烷 | D. | 1,2-二甲基丁烷 |
分析 根据烷烃的命名原则判断:
①长--选最长碳链为主链;并按主链上碳原子数目称为“某烷”;
②多--遇等长碳链时,支链最多为主链;
③近--离支链最近一端编号;用1、2、3…等数字给主链的各碳原子编号定位以确定支链的位置;
④小--支链编号之和最小;
⑤简--两取代基距离主链两端等距离时,从简单取代基开始编号,如取代基不同,就把简单的写在前面,复杂的写在后面.相同的取代基位置的阿拉伯数字要用逗号隔开,并在号数后面连一短线,中间用“-“隔开.
解答 解:A.根据烷烃的命名规则,2-甲基-3-乙基戊烷是正确的,故A正确;
B.支链编号之和应最小,正确的命名是3,3,4-三甲基己烷,故B错误;
C.选最长碳链为主链;并按主链上碳原子数目称为“某烷”,该烷烃最长的链为6个碳,正确名称为:2,5-二甲基己烷,故C错误;
D.选最长碳链为主链,该烷烃最长的链为5个碳,正确名称为:3-甲基戊烷,故D错误;
故选A.
点评 本题考查了有机物的命名,题目难度不大,该题注重了基础性试题的考查,侧重对学生基础知识的检验和训练,该题的关键是明确有机物的命名原则,有利于培养学生的规范答题能力.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | c(Na+)=c(HA-)+2c(A2-)+c(OH-) | |
| B. | c(H2A)+c(HA-)+c(A2-)=0.1 mol•L-1 | |
| C. | 将上述溶液稀释至0.01mol/L,c(H+)•c(OH-) 不变 | |
| D. | c (A2-)+c (OH-)=c (H+)+c (H2A) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
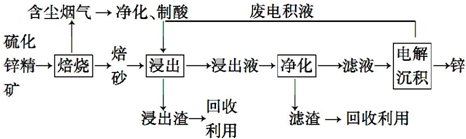
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
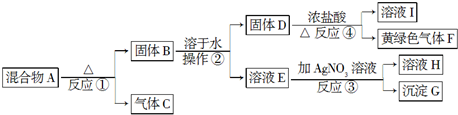


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
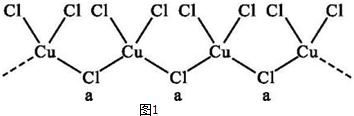
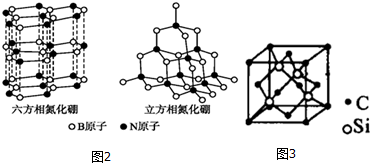
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液加热蒸干最终得不到氯化铁固体 | |
| B. | 用热的纯碱溶液清洗油污效果好 | |
| C. | 在H2、I2和HI组成的平衡体系加压后,混合气体颜色变深 | |
| D. | 常温下,将1 mL pH=3的醋酸溶液加水稀释至100 mL,测得其pH<5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素基态原子没有不成对电子;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层只有1个电子,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素基态原子没有不成对电子;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层只有1个电子,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com