

| ||
| ||


科目:高中化学 来源: 题型:
| A、11.2L | B、5.6L |
| C、4.48L | D、2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、饱和石灰水跟稀盐酸的反应:Ca(OH)2+2H+=Ca2++2H2O |
| B、用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ |
| C、将Fe2O3投入到稀盐酸的反应:Fe2O3+6H+=2Fe3++3H2O |
| D、Ba(OH)2溶液跟稀硫酸的反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、②③ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
装置 | 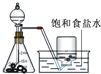 |  | 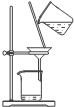 | 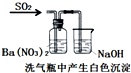 |
| 结论 | 用浓盐酸与二氧化锰制氯气 | 能证明非金属性 Cl>C>Si | 分离出Cl2与KI溶液反应生成的碘 | 白色沉淀一定是BaSO4 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、亚硝酸钠可以致癌 |
| B、我们应该禁止使用防腐剂 |
| C、苯甲酸钠可以作雪碧饮料的防腐剂 |
| D、绝大多数食品添加剂在过量使用时对人体有害的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com