
【题目】能使酸性高锰酸钾溶液褪色的是( )
A. 乙炔 B. 乙烷 C. 乙酸 D. 苯
 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】Cl2是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装 | 钢瓶 |
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式不正确的是
A. 电解饱和食盐水制取Cl2:2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
B. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
C. 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为满足不同的需要,人们应用原电池原理制作了多种电池。
(1)有人以化学反应2Zn+O2+4H+=2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作,则该原电池负极的电极反应为___________。
(2)FeCl3溶液常用于腐蚀印刷电路铜板,其反应的离子方程式为________________;若将此反应设计或原电池,则负极所用电极材料为___________,正极反应为_________________。
(3)美国阿波罗宇宙飞船上使用了一种新型发电装置—氢氧燃料电池,其构造如图所示,其中A、B两个电极均由多孔的碳炔组成,该电池的正极反应式为_________________,若该电池工作时溶液中增加1molH2O,则理论上电路中通过电子的物质的量为_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究铁和硝酸银溶液的反应,实验过程如下:
实验序号 | 实验操作 | 实验现象 |
I | 将一束光亮洁净的铁丝伸入到0.1mol/L 的AgNO3溶液中 | 铁丝表面有银白色固体析出,溶液逐渐变为浅绿色 |
II | 取少量实验I中上层清液,滴入K3[Fe(CN) 6]溶液 | 有蓝色沉淀生成 |
(1)根据上述实验现象,甲同学认为有Fe2+生成,铁和硝酸银溶液的反应的离子方程式是____________________。
(2)乙同学认为实验中可能生成Fe3+,设计并完成如下实验
实验序号 | 实验操作 | 实验现象 |
III | 取少量实验I中上层清液,滴入少量KSCN溶液,振荡 | 产生白色沉淀,溶液局部变红,振荡后红色消失,沉淀量增加 |
查阅资料:Ag+与SCN-生成白色沉淀AgSCN
乙同学判断有Fe3+,理由是 ____________________。
(3)乙同学继续探究红色褪去的原因,设计并完成如下实验
实验序号 | 实验操作 | 实验现象 |
IV | 取少量实验I中上层清液,滴加几滴稀盐酸 | 有白色沉淀生成 |
V | 取1mLFe(NO3)3溶液,滴加2滴等浓度的KSCN溶液,振荡,再滴加少量AgNO3溶液 | 溶液变红;振荡溶液颜色无变化,滴加AgNO3后溶液红色褪去,产生白色沉淀. |
① 实验IV的目的是____________________;
② 用平衡移动原理解释,实验V中溶液红色褪去的原因____________________。
(4)丙认为溶液中Fe3+是Fe2+被Ag+氧化所致。按下图连接装置并进行实验,一段时间后取出左侧烧杯溶液加入KSCN溶液,溶液变红

① 其中X溶液是____________________;
② 由实验得出Ag+和Fe2+反应的离子方程式是____________________;
③ 丙同学的实验设计及结论是否合理,请说明理由____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短同期主族元家X、Y、Z、W、Q的原子序数依次增大,原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z、W是常见金属,乙是同周期中原子半径最大的元素,W的简单离子是同周期中离子半径最小的,X和Z原子序数之和与Q的原子序数相等。下列说法正确的是
A. 气态氢化物的稳定性:X>Y>Q
B. X与Q形成的化合物和Z与Q形成的化合物的化学键类型相同
C. Z、W、Q三种元素最高价氧化物对应的水化物之间两两均可反应生成盐和水
D. 相同质量的Z和W单质分别与足量稀盐酸反应时,乙的单质制得的氢气多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH﹣4e﹣+H2O=CH3COOH+4H+ . 下列说法中正确的是( )
A.正极上发生的反应为:O2+2H2O+4e﹣=4OH﹣
B.电池反应的化学方程式为:CH3CH2OH+O2=CH3COOH+H2O
C.检测时,溶液中的H+向负极移动
D.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、铜是重要的过渡元素,其化合物具有广泛的用途。
(1)钴位于元素周期表中第____族,基态Cu的核外电子排布式是_________。元素铁与铜的第二电离能分别为:ICu=1958kJ/mol、IFe=1561kJ/mol,ICu>IFe的原因是______________。
(2)有机铁肥三硝酸六尿素合铁(Ⅲ),化学式为:[Fe(H2NCONH2)6](NO3)3.
①尿素分子中C原子的杂化方式是_______,所含非金属元素的电负性由大到小的顺序是_____。
②[Fe(H2NCONH2)6](NO3)3中“H2NCONH2”与Fe(Ⅲ)之间的作用力是_______。根据价层电子对互斥理论推测NO3-的空间构型为_________。
(3)Fe3+可用SCN-检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是________________,原因是________________。
(4)FeCl3晶体易溶于水喝乙醇,用酒精灯加热即可气化,由此可知FeCl3的晶体类型为_____;S和Fe形成的某化合物,其晶胞如图一所示,则该物质的化学式为_______。
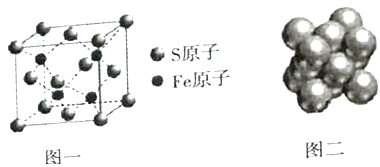
(5)Cu晶体的堆积方式如图二所示,晶体中Cu原子的配位数为_______;设Cu原子半径为a,晶体空间利用率为_______(用含a的式子表达,不化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据图回答下列问题:

(1)若烧杯中溶液为稀硫酸,则观察到的现象是_______________,电流表指针____(填“偏转”或“不偏转”),两极反应式为:正极_______________;负极______________________。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________(填Mg或Al),总反应方程式为______。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如下图所示:A、B两个电极均由多孔的碳块组成。该电池的正极反应式为:___________________________。
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com