
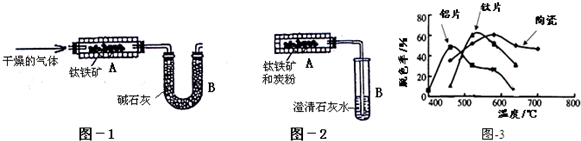
分析 (1)已知FeTiO3被H2还原后,生成Fe、TiO2和水,反应的化学方程式为:FeTiO3+H2 $\frac{\underline{\;\;△\;\;}}{\;}$Fe+TiO2+H2O;
(2)根据关系式:CaCO3~CO2~O2,计算钛铁矿中可提取氧的质量分数;
(3)①对学生乙的设想提出改进措施:改用图1装置,为了CO充分反应生成CO2,在U型管B之前增加盛有CuO粉末的燃烧管;为了防止空气中的CO2进入U型管B,在B之后增加盛碱石灰的干燥管;②实验自始至终需持续向装置A中通入N2,反应前可以将装置中的空气赶出,反应开始后可将CO2及时赶出使之被碱石灰吸收;
(4)根据图中脱色率与温度关系解题.
解答 解:(1)已知FeTiO3被H2还原后,生成Fe、TiO2和水,反应的化学方程式为:FeTiO3+H2 $\frac{\underline{\;\;△\;\;}}{\;}$Fe+TiO2+H2O;故答案为:FeTiO3+H2 $\frac{\underline{\;\;△\;\;}}{\;}$Fe+TiO2+H2O;
(2)根据关系式:CaCO3~CO2~O2,钛铁矿中可提取氧的物质的量为$\frac{c}{100}$mol,则钛铁矿中可提取氧的质量分数的表达式为$\frac{32c}{100a}$,故答案为:$\frac{32c}{100a}$;
(3)①对学生乙的设想提出改进措施:改用图1装置,为了CO充分反应生成CO2,在U型管B之前增加盛有CuO粉末的燃烧管;为了防止空气中的CO2进入U型管B,在B之后增加盛碱石灰的干燥管;
故答案为:CuO粉末;在B之后增加盛碱石灰的干燥管;
②改进后,实验自始至终需持续向装置A中通入N2,反应前可以将装置中的空气赶出,反应开始后可将CO2及时赶出使之被碱石灰吸收;
故答案为:反应前将装置中的空气赶出,反应开始后可将CO2及时赶出使之被碱石灰吸收;
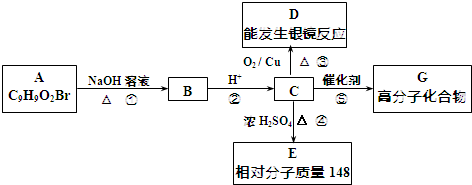
(4)a.由图知,500度以下钛片最差,故a错误;
b.由图知,在520℃时,脱色率最高,钛片载体的光催化活性最好,故b正确;
c.520℃后钛片催化活性随温度的升高而较低,故c错误;
d.由图知,相同温度时,不同的载体(钛片、铝片、陶瓷),TiO2薄膜的光催化活性不同,故d正确.
故选bd.
点评 本题考查钛铁矿中可提取氧的质量分数,设计实验方案的设计与改进,难度中等,明确实验原理是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16g甲烷所含的质子数为10NA | |
| B. | 常温常压下,18g重水所含的原子数为3NA | |
| C. | 标准情况下,22.4L四氯化碳所含有的分子数为NA | |
| D. | 常温常压下,1mol氦气分子所含有的核外电子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,23 g NO2含有0.5NA个氮原子 | |
| B. | 1L 0.1 mol•L-1硫酸铵溶液中含有0.1NA个NH4+ | |
| C. | 常温常压下,22.4 L CCl4含有NA个CCl4分子 | |
| D. | 1mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.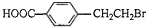 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$ +NaBr+H2O.反应⑤的化学方程式是
+NaBr+H2O.反应⑤的化学方程式是 .
.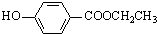 、
、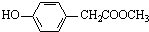 、还有4种.
、还有4种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘晶体、碘蒸气是同素异形体 | |
| B. | 固态NaCl和HCl的熔化所克服的作用力不同 | |
| C. | ${\;}_{92}^{235}$U和${\;}_{92}^{238}$U是中子数不同质子数相同的同种核素 | |
| D. | 金刚石和石墨是同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定不含共价键,共价化合物中一定不含离子键 | |
| B. | 分子间作用力越大,分子的热稳定性就越大 | |
| C. | 可能存在不含任何化学键的晶体 | |
| D. | 酸性氧化物形成的晶体一定分子晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com