
分析 通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,溶液中溶质为醋酸钡和氢氧化钡,反应平衡时,2c(Ba2+)=c(CH3COO-)=bmol/L,溶液中c(H+)=c(OH-)=10-7mol/L,溶液呈中性,醋酸电离平衡常数K=$\frac{c(C{H}_{3}CO{O}^{-}).c({H}^{+})}{c(C{H}_{3}COOH)}$.
解答 解:通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,溶液中溶质为醋酸钡和氢氧化钡,反应平衡时,2c(Ba2+)=c(CH3COO-)=bmol/L,溶液中c(H+)=c(OH-)=10-7mol/L,溶液呈中性,醋酸电离平衡常数K=$\frac{c(C{H}_{3}CO{O}^{-}).c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{b×1{0}^{-7}}{\frac{a}{2}-b}$=$\frac{2b×1{0}^{-7}}{a-2b}$,
故答案为:$\frac{2b×1{0}^{-7}}{a-2b}$.
点评 本题考查电离平衡常数的有关计算、弱电解质的电离等知识点,侧重考查学生分析计算能力,注意电离平衡常数的表达式的书写.


科目:高中化学 来源: 题型:选择题
| A. | 3:3:2 | B. | 2:2:3 | C. | 3:28:27 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、CO32- | B. | Na+、HCO3- | C. | CO32-、HCO3- | D. | Na+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| B. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| C. | 硫具有还原性,可用硫粉覆盖地上洒落的汞 | |
| D. | 硅是重要的半导体材料,常用于制作光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
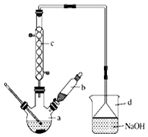 溴苯是一种化工原料,实验室合成溴体的装置示意图及有关数据如表:
溴苯是一种化工原料,实验室合成溴体的装置示意图及有关数据如表:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
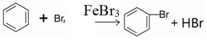 ;装置d的作用吸收HBr和溴蒸气;防止倒吸.
;装置d的作用吸收HBr和溴蒸气;防止倒吸.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水晶项链和餐桌上的瓷盘都是硅酸盐材料 | |
| B. | 用于制作灯饰外壳材料的聚苯乙烯塑料属于有机高分子材料 | |
| C. | 氮化硅结构陶瓷可以用来做发动机的部件 | |
| D. | 高吸水性材料、光敏性材料等属于功能高分子材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com