
(1)亚铜离子(Cu+)基态时的价电子排布式表示为 。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 (用元素符号表示)。
(3)Cu晶体的堆积方式是 (填堆积方式名称),其配位数为 ;往Cu的硫酸盐溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是_____
A.[Cu (NH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Cu(NH3)4 ]2+中Cu2+给出孤对电子,NH3提供空轨道
C.[Cu (NH3)4]SO4组成元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为正四面体
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为 。
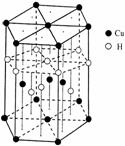

(5)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如右图所示。则该化合物的化学式为 。
科目:高中化学 来源: 题型:
有X、Y两种原子,X原子的M电子层比Y原子的M电子层少3个电子,Y原子的L电子层的电子数恰好为X原子L电子层电子数的2倍,X和Y分别是( )
A、碳和铝
B、硅和钠
C、硼和氮
D、氯和碳
查看答案和解析>>
科目:高中化学 来源: 题型:
仅用一种试剂鉴别如下物质:苯、CCl4、NaI溶液、NaCl溶液、Na2SO3溶液,下列试剂中不能选用的是( )
A.溴水 B.FeCl3溶液
C.酸性KMnO4 D.AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
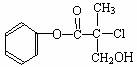
某有机物A是农药生产中的一种中间体,其结构简式如
下。下列叙述正确的是
A.有机物A属于芳香烃
B.有机物A可以和Br2的CCl4溶液发生加成反应
C.有机物A和浓硫酸混合加热,可以发生消去反应
D.1mol A和足量的NaOH溶液反应,可以消耗3mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)氢是未来最好的能源选择,制取氢气的成熟的方法有很多,利用甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g) + H2O(g) CO2(g) + 3H2(g)
CO2(g) + 3H2(g)  H(298K)=+ 49.4 kJ/mol
H(298K)=+ 49.4 kJ/mol
一定条件下,向容积为2L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),实验测得:达到平衡状态时,吸收热量19.76 kJ。则
①达平衡时混合气体的压强是反应前的 倍。
②该条件下的该反应的平衡常数是 (结果保留两位有效数字)。
③该条件下反应达平衡状态的依据是(填序号) 。
A.v正(CH3OH)=v正(CO2) B.混合气体的密度不变
C.c(CH3OH)=c(H2O) D.混合气体的总物质的量不变
(2) 甲、乙两容器体积相等,甲容器通入1 mol SO2和1 mol O2,乙容器通入1 mol SO3和0.5 mol O2,发生反应:2SO2(g) + O2 (g)  2SO3(g)
2SO3(g)  H<0,甲、乙起始反应温度相同,均和外界无热量交换,平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系为a+b 1(填“﹤”、“﹥”或“=”) 。
H<0,甲、乙起始反应温度相同,均和外界无热量交换,平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系为a+b 1(填“﹤”、“﹥”或“=”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物中碳和氢原子个数比为3:4,不能与溴水反应却能使酸性KMnO4溶液褪色。其蒸气密度是相同状况下甲烷密度的7.5倍。在铁存在时与溴反应,能生成两种一溴代物。该有机物可能是( )

查看答案和解析>>
科目:高中化学 来源: 题型:
某同学在实验室进行1,2-二溴乙烷的消去反应,按下列步骤进行,请填空:
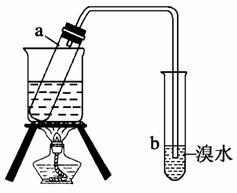
(1)按图连接好仪器装置并________。
(2)在试管a中加入2 mL 1,2-二溴乙烷和5 mL 10% NaOH的________溶液,再向试管中加入________。
(3)在试管b中加少量溴水。
(4)用________加热试管里的混合物,持续加热一段时间后,把生成的气体通入溴水中,观察到的现象是____________________。
根据以上实验,完成以下问题:
①写出所发生反应的化学方程式:____________________。
②本实验中应注意的问题有:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com