
【题目】在一固定体积的密闭容器中,进行下列反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH=akJ·mol-1
CO(g)+H2O(g) ΔH=akJ·mol-1
其化学平衡常数K和温度T的关系如下表所示:
T(℃) | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
则下列有关叙述正确的是
A.a<0
B.可测量容器总压强变化来判定化学反应是否达到平衡
C.温度为830℃时,若c(CO2)·c(H2)>c(CO)·c(H2O),此时v正>v逆
D.温度不变,增大c(CO2),平衡右移,K增大
科目:高中化学 来源: 题型:
【题目】已知酸性 ![]() >H2CO3>
>H2CO3>![]() >HCO3- ,综合考虑反应物的转化率和原料成本等因素,将
>HCO3- ,综合考虑反应物的转化率和原料成本等因素,将 转变
转变![]() 的方法有( )
的方法有( )
A.与稀 H2SO4 共热后,加入足量的 NaHCO3 溶液
B.与稀 H2SO4 共热后,加入足量的 Na2CO3 溶液
C.与足量的 NaOH 溶液共热后,再加入适量 H2SO4
D.与足量的 NaOH 溶液共热后,再通入足量 CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示每一方框表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且加热X生成的A与C的物质的量之比为1∶1,B为常见液体。
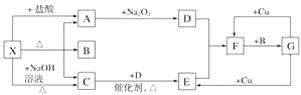
试回答下列问题:
(1)X是________(填化学式,下同),F是__________。
(2)A―→D反应的化学方程式为_______。
(3)G与Cu的反应中,G表现的性质为______。
(4)X与过量NaOH溶液反应生成C的离子方程式为_____________。
(5)以C、B、D为原料可生产G,若使amol C完全转化为G,理论上至少需要D___ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,H2 (g)+CO2 (g) ![]() CO(g)+H2O(g)的平衡常数K=9/4。该温度下在甲、乙、丙三个相同的恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是
CO(g)+H2O(g)的平衡常数K=9/4。该温度下在甲、乙、丙三个相同的恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/ mol·L-1 | 0.010 | 0.020 | 0.020 |
c(CO2)/ mol·L-1 | 0.010 | 0.010 | 0.020 |
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲和丙中H2的转化率均是60%
C.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
D.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) ΔH=57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g) ΔH=57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
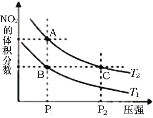
A.由状态B到状态A,可以用加热的方法
B.A、C两点气体的颜色:A深,C浅
C.A、C两点的反应速率:A>C
D.A、C两点气体的平均相对分子质量:A>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马兜铃酸是一种致癌物。如图为马兜铃酸的结构简式,R,R1,R2代表-H,-OH或-OCH3中的一种或几种,下列有关说法正确的是

A. 若R代表—OH,R1,R2代表—H,则对应有机物的分子式为C16H9NO7
B. 若R代表—H,R1,R2代表—OCH3,则对应有机物的结构中含有4种官能团
C. 若R,R1,R2均代表—H,则对应有机物能发生取代反应,氧化反应和水解反应
D. 若R,R1,R2中至少有1个代表—H,则对应的有机物最多有9种结构(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置________。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________。
(3)装置A中①的名称是________,进水的方向是从________口进水。装置B在分液时为使液体顺利滴下,除打开活塞外,还应进行的具体操作是____。
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:
![]()
![]()
![]()
![]()
![]() ―→
―→![]()
粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液 ④调节溶液的pH等于7 ⑤溶解 ⑥过滤 ⑦蒸发
正确的操作顺序是________(填选项字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦
c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用元素周期律,判断下列语句,其中正确的组合是( )
①碱金属单质的熔点随原子序数的增大而降低
②砹(![]() )是第Ⅶ
)是第Ⅶ![]() 族,其氢化物的稳定性小于
族,其氢化物的稳定性小于![]()
③根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
⑤铊(![]() )与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
⑥若X+和Y2﹣的核外电子层结构相同,则原子序数:X>Y
A.①③④B.①②⑥C.③④⑤D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。一种利用钛铁矿( 主要成分为FeTiO3 和少量Fe2O3 )进行钛白粉和LiFePO4 的联合生产工艺如下图所示:
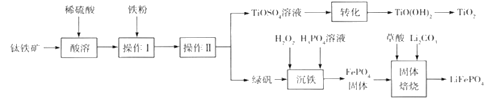
回答下列问题:
(1) LiFePO4中Fe的化合价是_______________________。
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是__________________________________。
(3)用离子方程式表示操作I加入铁粉的目的:__________________________。操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器的名称是___________。
(4)TiO2+易水解,则其水解的离子方程式为______________________;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热的目的是________________________________。
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+ 沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=_______mol/L[已知:该温度下,Ksp(FePO4)=1.0×10-22]。
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com