
| A. | 有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿 | |
| B. | 常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成 | |
| C. | 金属钠放入硫酸铜溶液中可以置换出金属铜 | |
| D. | 将铜丝插入浓硫酸加热,反应后把水加入反应器中,观察硫酸铜溶液的颜色将表面 |
分析 A.Cu2(OH)2C03能溶于盐酸;
B.常温下铜与氯气不反应;
C.钠与盐溶液的反应,是钠与水反应;
D.反应后溶液中含有大量的硫酸,应该把混合物加入水中.
解答 解:A.Cu2(OH)2C03能溶于盐酸,所以能用盐酸除去铜绿,故A正确;
B.常温下铜与氯气不反应,因此观察不到现象,故B错误;
C.金属钠放入硫酸铜溶液中,Na与水反应生成NaOH,NaOH与硫酸铜反应生成氢氧化铜沉淀,不能置换出Cu,故C错误;
D.铜丝与浓硫酸加热生成硫酸铜后,再把混合物加入水中形成硫酸铜溶液,而不能把水加入反应混合物中,防止剩余的浓硫酸稀释时溅出,故D错误;
故选A.
点评 本题考查了钠、铜及其化合物的性质,题目难度不大,侧重于基础知识的考查,注意把握钠与酸、碱、盐溶液的反应.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22g2H218O中含有的质子数为10NA | |
| B. | 电解58.5g熔融的NaCl,能产生11.2 L氯气(标准状况)、23.0 g金属钠 | |
| C. | 1.00molNaCl中,所有Na+的最外层电子总数为10NA | |
| D. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [H+]很小的溶液一定呈碱性 | |
| B. | pH=7的溶液一定呈中性 | |
| C. | [OH-]=[H+]的溶液一定呈中性 | |
| D. | 不能使酚酞试液变红的溶液一定呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmol•L?1的NaCl溶液中所含Na+为NA个 | |
| B. | 标准状况下,11.2 L SO3所含的分子数为0.5NA | |
| C. | 0.1 mol CH4所含的电子数为1NA | |
| D. | 2molNO和1mol O2混合,所得气体分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
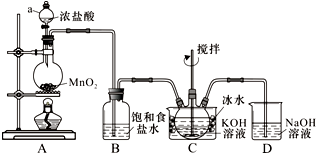 实验室用图所示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4.
实验室用图所示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
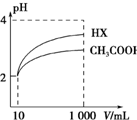 弱酸HA的电离常数Ka=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$.25℃时,几种弱酸的电离常数如下:
弱酸HA的电离常数Ka=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$.25℃时,几种弱酸的电离常数如下:| 弱酸化学式 | HNO2 | CH3COOH | HCN | H2CO3 |
| 电离常数 | 5.1×10-4 | 1.8×10-5 | 6.2×10-10 | K1=4.4×10-7 K2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com