
| A. | 酸性溶液中:C2H5OH、Na+、MnO4-、NO3- | |
| B. | 溶有二氧化硫气体的溶液中:NH4+、Fe2+、SO42-、Cl- | |
| C. | 加入铝产生H2的溶液:Na+、K+、HCO3-、AlO2- | |
| D. | 常温下,水电离c(H+)=1×10-10mol•L-1的溶液:Al3+、Cu2+、SO42-、Cl- |
分析 A.酸性条件下,高锰酸根离子具有强氧化性,不能和还原性物质共存;
B.二氧化硫具有还原性,和强氧化性离子不能共存;
C.加入Al反应生成氢气的溶液为强碱性或弱氧化性酸溶液;
D.常温下,水电离c(H+)=1×10-10mol•L-1的溶液中抑制水电离,溶液呈强酸性或强碱性.
解答 解:A.酸性条件下,高锰酸根离子具有强氧化性,能将乙醇氧化生成乙酸,所以不能大量共存,故A错误;
B.二氧化硫和这几种离子不反应,所以能大量共存,故B正确;
C.加入Al反应生成氢气的溶液为强碱性或弱氧化性酸溶液,碱性条件下碳酸氢根离子不能大量共存,酸性条件下碳酸氢根离子和偏铝酸根离子都不能大量共存,故C错误;
D.常温下,水电离c(H+)=1×10-10mol•L-1的溶液中抑制水电离,溶液呈强酸性或强碱性,强碱性条件下,铝离子和铜离子不能大量共存,故D错误;
故选B.
点评 本题考查离子共存,为高频考点,明确复分解反应条件、氧化还原反应内涵是解本题关键,侧重考查复分解反应和氧化还原反应,注意C溶液不能是强氧化性酸溶液,为易错点.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | 对一个可逆反应,正反应方向是吸热的,当升高温度时,正反应速率增大,逆反应速率减小 | |
| B. | 正催化剂能提高活化分子百分数和活化分子浓度 | |
| C. | 压强增大,化学反应速率一定增大 | |
| D. | 浓度升高化学平衡一定发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓的强酸和稀的强碱反应 | B. | 浓的弱酸和稀的强碱反应 | ||
| C. | 等浓度的强酸和弱碱反应 | D. | 稀的强酸和浓的弱碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
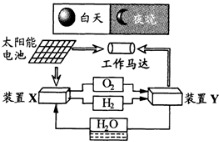
| A. | 装置X能实现燃料电池的燃料和氧化剂再生 | |
| B. | 装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH- | |
| C. | 装置X是原电池,装置Y是电解池 | |
| D. | 装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某酸性溶液中可能大量存在:NH4+、Fe3+、NO3-、I- | |
| B. | 由水电离的c(H+)=10-12 mol•L-1的溶液中,Al3+、Cl-、Ba2+、NO3-一定不能大量共存 | |
| C. | 向NH3•H2O溶液中滴加少量AlCl3溶液,发生反应:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 向含有1 mol FeBr2的水溶液中通入标准状况下11.2 L Cl2,发生反应:Cl2+2Fe2+═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
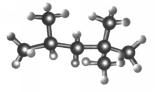 “辛烷值”用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100,如图是异辛烷的球棍模型,则异辛烷的系统命名为( )
“辛烷值”用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100,如图是异辛烷的球棍模型,则异辛烷的系统命名为( )| A. | 1,1,3,3-四甲基丁烷 | B. | 2,2,4-甲基庚烷 | ||
| C. | 2,4,4-三甲基戊烷 | D. | 2,2,4-三甲基戊烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com