
【题目】Ⅰ.含CN-电镀废水的一种方法如图(CN-和CNO-中N的化合价均为-3价)

某学习小组依据上述方法,用如图实验装置进行该电镀废水处理的研究。

操作步骤:
ⅰ.先关闭装置甲的活塞,再将含CN-废水与过量NaClO溶液混合,取200mL混合液[其中c(CN-)相当于0.200mol·L-1]加入装置甲中。
ⅱ.待装置甲中充分反应后,打开活塞,使溶液全部流入装置乙中,关闭活塞。
ⅲ.测定干燥管Ⅰ增加的质量。
(1)装置甲玻璃仪器名称为________________;装置乙中反应的离子方程式为________________。
(2)装置丙中的试剂是________________,装置丁的作用是________________。
(3)假定上述实验中的气体都被充分吸收。若干燥管Ⅰ增重1.408g。则CN-被处理的百分率为________________。
(4)你认为用此装置进行实验,CN-实际被处理的百分率与(3)中比较会________________(填“偏高”、“偏低”、“无法确定”或“无影响”),简述你的理由________________。
Ⅱ.防治空气污染,燃煤脱硫很重要。目前,科学家对Fe3+溶液脱硫技术的研究已取得新成果。
(5)某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液中后,各取10mL反应液分别加入编号为A、B、C的试管中,并设计以下3种实验方案:
方案①:A中加入少量KMnO4溶液,溶液紫红色褪去。
方案②:B中加入KSCN溶液,溶液不变红,再加入新制的氯水,溶液变红。
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀。
上述实验方案中不合理的是________________(填方案编号)。
【答案】分液漏斗 2CNO-+6ClO-+8H+=N2↑+2CO2↑+3Cl2↑+4H2O 浓硫酸 吸收混合气中的Cl2 80.0% 偏高 部分Cl2在装置丁中没有被吸收而在干燥管Ⅰ中被吸收(或“偏低:部分CO2残留在装置内没有在干燥管Ⅰ中被完全吸收”或“无法确定:部分Cl2在干燥管Ⅰ中被吸收,部分CO2没有在干燥管Ⅰ中被吸收”等合理答案均给分) 方案①
【解析】
(1)装置甲玻璃仪器名称为分液漏斗;装置乙中,CNO-被ClO-在酸性溶液中进一步氧化,生成N2、Cl2和CO2等,反应的离子方程式为2CNO- +6ClO-+8H+=N2↑+2CO2↑+3Cl2↑+4H2O。答案为:分液漏斗;2CNO- +6ClO-+8H+=N2↑+2CO2↑+3Cl2↑+4H2O;
(2)从实验装置中可以看出,在分液漏斗甲中,过量NaClO与CN-混合,发生反应生成CNO-,将反应后的液体与乙装置内的稀硫酸混合,发生反应生成N2、Cl2和CO2等;从装置丁看,铜网的作用是吸收Cl2,干燥管Ⅰ是吸收CO2,由CO2的质量计算含CN-电镀废水中CN-的质量;干燥管Ⅱ是吸收进入空气中的CO2、H2O等,防止被干燥管Ⅰ吸收,从而引起CO2的质量偏差。由此可推出丙装置中的溶液应能吸收反应生成的水蒸气,所以应加入浓硫酸。装置丁的作用是吸收混合气中的Cl2。答案为:浓硫酸;吸收混合气中的Cl2;
(3)假定上述实验中的气体都被充分吸收,若干燥管Ⅰ增重1.408g,则CN-被处理的百分率为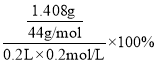 =80.0%。答案为:80.0%;
=80.0%。答案为:80.0%;
(4)用此装置进行实验,难以保证Cl2被丁装置完全吸收,也无法保证生成的CO2被干燥管Ⅰ中的碱石灰完全吸收,所以CN-实际被处理的百分率与(3)中比较会偏高,理由是:部分Cl2在装置丁中没有被吸收而在干燥管Ⅰ中被吸收(或“偏低;部分CO2残留在装置内没有在干燥管Ⅰ中被完全吸收”或“无法确定:部分Cl2在干燥管Ⅰ中被吸收,部分CO2没有在干燥管Ⅰ中被吸收”等合理答案均给分)。
(5)方案①:A中加入少量KMnO4溶液,因为Fe2+、Cl-都能将MnO4-还原,所以溶液紫红色褪去不能证明Fe2+的存在,方案①不合理;
方案②:B中加入KSCN溶液,溶液不变红,再加入新制的氯水,溶液变红,则证明含有Fe2+,方案②合理;
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀,证明溶液中含有SO42-,方案③合理;
上述实验方案中,不合理的是方案①。答案为:方案①。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】利用如图装置可以验证非金属性的变化规律。
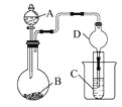
(1)仪器A的名称为________,干燥管D的作用是________________。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为_________________,离子方程式为______。
(3)若要证明非金属性:S>C>Si,则A中加________、B中加Na2CO3、C中加________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,下图装置是用燃烧法确定有机物M分子式的常用装置。
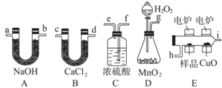
(1)产生的氧气按从左到右方向流动,所选装置各导管的连接顺序是______________________;
(2)C装置中浓硫酸的作用是___________________;
(3) 若准确称取有机物M (只含C、H、O三种元素中的两种或三种) 0.70 g,经充分燃烧后,A管质量增加2.2 g,B管质量增加0.9 g,则该有机物的实验式为__________________;
(4)已知在相同条件下该M蒸气相对氢气的密度为35,则M的分子式为_____________。若有机物M不能使溴水褪色,且其核磁共振氢谱只有一个吸收峰,则M的结构简式为________________。若该有机物M分子中所有碳原子一定都在同一平面内,且能使溴水褪色,在催化剂作用下能与H2加成,其加成产物分子中含有3个甲基,则M的结构简式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中:
A.![]()
B.![]()
C.![]()
D.![]()
(1)水只作氧化剂的是 (填序号,下同),水只作还原剂的是 ,水既作氧化剂又作还原剂的是 。
(2)用双线桥表示D反应中电子转移情况。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 对于N2(g) + 3H2(g) ![]() 2NH3(g)达到平衡,在温度不变、容积不变的密闭容器中充入N2,化学平衡常数变大
2NH3(g)达到平衡,在温度不变、容积不变的密闭容器中充入N2,化学平衡常数变大
B. 对某一可逆反应,升高温度则化学平衡常数一定变大
C. 平衡常数发生变化,化学平衡必定发生移动达到新的平衡
D. 改变条件,使反应物的平衡转化率都增大,该可逆反应的平衡常数一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X 、Y、Z 的原子序数依次增大,W、X 同主族,Y原子的最外层电子数等于X原子的电子总数,Z原子的电子总数等于W、X、Y 三种原子的电子数之和,Z的最高价氧化物对应水化物的化学式为HnZO2n+2 。W、X、Y 三种元素形成的一种化合物的结构如图所示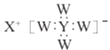 。下列说法错误的是
。下列说法错误的是
A.X常用来制造电池
B.Y、Z形成的化合物常用于制取单质Y
C.W的简单离子半径可能大于X的简单离子半径
D.Z的单质的水溶液需保存在棕色试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2SO3、H2CO3分别属于中强酸和弱酸,H2SO3![]() H++HSO3-,HSO3-
H++HSO3-,HSO3-![]() H++SO32-;H2CO3
H++SO32-;H2CO3![]() H++HCO3-;HCO3-
H++HCO3-;HCO3-![]() H++CO32-;电离平衡常数分别为K1、K′1、K2、K′2,已知K1>K′1≈K2>K′2,则溶液中不可以大量共存的离子组是 ( )
H++CO32-;电离平衡常数分别为K1、K′1、K2、K′2,已知K1>K′1≈K2>K′2,则溶液中不可以大量共存的离子组是 ( )
A. SO32-、HCO3-B. HSO3-、CO32-C. SO32-、CO32-D. HSO3-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一致且正确的是
A. 加入有色布条,一会儿有色布条褪色,说明溶液中有HCl存在
B. 溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在
C. 加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有Cl2存在
D. 加入Na2CO3溶液,有气泡产生,说明有HClO分子存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数的值,在3(NH4)2SO4 ![]() N2 + 4NH3↑+ 3SO2↑+6H2O中,当有12NA个电子转移时,以下说法正确的是
N2 + 4NH3↑+ 3SO2↑+6H2O中,当有12NA个电子转移时,以下说法正确的是
A.有6 molS (+6价)被还原B.有4 mol SO2生成
C.有4 molN (-3价)被还原D.有8 mol (NH4)2SO4分解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com