
| A. | 甲烷分子是以碳原子为中心的正四面体结构 | |
| B. | 甲烷不能使溴水或高锰酸钾溶液褪色 | |
| C. | 甲烷在空气中加热到1000℃,分解成炭黑和氢气 | |
| D. | 甲烷在氧气中燃烧生成二氧化碳和水的实验事实说明甲烷中含有碳元素和氢元素 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
| 甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有较强酸性和还原性 | 易溶于水,难溶于乙醇 |
| 实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
| 产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.86 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量SO2通入NaClO溶液中:SO2+3ClO-+H2O═SO42-+Cl-+2HClO | |
| B. | 等物质的量的MgCl2、Ba(OH)2 和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 用硫氰化钾溶液可以检验溶液中的Fe3+:Fe3++3SCN-═Fe(SCN)3↓ | |
| D. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制 Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 空硬质玻璃管 | 硬质玻璃管+氧化铜 | 硬质玻璃管+铜 | |
| 质量(g) | w | m | n |
| A. | $\frac{16m}{m-n}$ | B. | $\frac{16(w-n)}{m-n}$ | C. | $\frac{16n}{m-n}$ | D. | $\frac{16(n-w)}{m-n}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A原子最外电子层上的电子数比B少 | |
| B. | B单质的氧化性大于A单质 | |
| C. | A的非金属性比B强 | |
| D. | B的气态氢化物稳定性大于A的气态氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
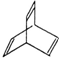 有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式
有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式
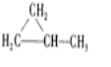
 、
、
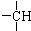 及一个-Cl,它的可能结构只有四种.请写出这四种可能的结构简式
及一个-Cl,它的可能结构只有四种.请写出这四种可能的结构简式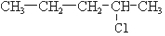 ②
②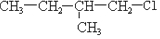
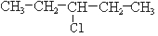 ④
④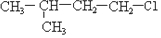 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据组成原电池的条件,设计一个原电池,画出示意图并标出原电池的正、负极和电子的流向(画在下面方框中),写出电极反应式.
根据组成原电池的条件,设计一个原电池,画出示意图并标出原电池的正、负极和电子的流向(画在下面方框中),写出电极反应式.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com