
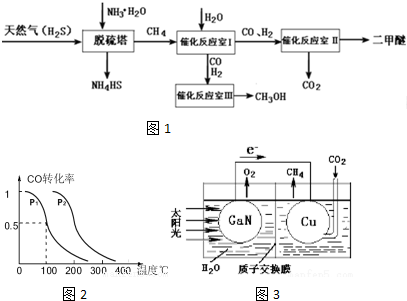
���� ��1�����飨CH4��������Cԭ�ӵĦҼ����Ӷ���Ϊ4��û�йµ��Ӷԣ�����Cԭ��Ϊ�ӻ�sp3���ݴ�ȷ���ռ乹�ͣ�
��2��һ����������NH4HS��Һ��ͨ��������õ�������ʹ��ˮ��������Ӧ����������һˮ�ϰ�������ԭ���غ�͵����غ���ƽ��д��ѧ����ʽ��
��3���������̴���Ӧ����ΪCO��H2��һ�������£����ɶ����ѺͶ�����̼��
��Ϣ�2H2��g��+CO��g��?CH3OH��g������H=-90.8kJ•mol-1
��2CH3OH��g��?CH3OCH3��g��+H2O��g������H=-23.5kJ•mol-1
��CO��g��+H2O��g��?CO2��g��+H2��g������H=-41.3kJ•mol-1
�ɸ�˹����ͨ���١�2+��+�۵õ���
��4���ٲ�ȡ���Ʊ�������������ͼ��֪�¶���ͬʱ������ƽ��ʱ��ѹǿΪP2��COת���ʸߣ���ӦΪ���������С�ķ�Ӧ������ѹǿƽ���������С�ķ����ƶ���
�ں��º����£�����amolCO��2amolH2��CO��H2�ı�����ԭƽ����ͬ����ЧΪ����ѹǿ��ƽ���������С�ķ����ƶ�����������Ӧ�ƶ���
����������ʽ���CO��H2�ڴ��������·�Ӧ���ɼ״���ƽ��ʱ��Ӧ��������ֵ�Ũ�ȣ�����ƽ�ⳣ��k=$\frac{c��CH{\;}_{3}OH��}{c��CO��c{\;}^{2}��H{\;}_{2}��}$���㣻
��5�����ݵ�������ͭ�缫ΪCO2�õ��ӷ�����ԭ��Ӧ����CH4��
��� �⣺��1�����飨CH4��������Cԭ�ӵĦҼ����Ӷ���Ϊ4��û�йµ��Ӷԣ�����Cԭ��Ϊ�ӻ�sp3����CH4���ӵĿռ乹��Ϊ�������壬�ʴ�Ϊ���������壻
��2��һ����������NH4HS��Һ��ͨ��������õ�������ʹ��ˮ��������Ӧ����������һˮ�ϰ�������ԭ���غ�͵����غ���ƽ��д��ѧ����ʽΪ��2NH4HS+O2$\frac{\underline{\;һ��������\;}}{\;}$2NH3•H2O+2S�����ʴ�Ϊ��2NH4HS+O2$\frac{\underline{\;һ��������\;}}{\;}$2NH3•H2O+2S����
��3�������̴���Ӧ����ΪCO��H2��һ�������£����ɶ����ѺͶ�����̼������ʽΪ3H2+3CO?CH3OCH3+CO2��
�֢�2H2��g��+CO��g��?CH3OH��g����H=-90.8kJ•mol-1
��2CH3OH��g��?CH3OCH3��g��+H2O��g����H=-23.5kJ•mol-1
��CO��g��+H2O��g��?CO2��g��+H2��g����H=-41.3kJ•mol-1
�ɸ�˹���ɿ�֪���١�2+��+�ۿɵ�����Ӧ���Ȼ�ѧ����ʽ����3H2��g��+3CO��g��?CH3OCH3��g��+CO2��g����H=-90.8kJ•mol-1��2-23.5kJ•mol-1-41.3kJ•mol-1=-246.4kJ•mol-1��
�ʴ�Ϊ��3H2��g��+3CO��g��?CH3OCH3��g��+CO2��g����H=-246.4kJ•mol-1��
��4������ͼ��֪�¶���ͬʱ������ƽ��ʱ��ѹǿΪP2��COת���ʸߣ�ƽ��������Ӧ�����ƶ�����ӦΪ���������С�ķ�Ӧ������ѹǿƽ���������С�ķ����ƶ�����P1��P2���ʴ�Ϊ������
�ں��º����£�������a mol CO��2a mol H2��CO��H2�ı�����ԭƽ����ͬ����ЧΪ����ѹǿ��ƽ���������С�ķ����ƶ�����������Ӧ�ƶ���CO��ת�������ʴ�Ϊ������
����������ʽ���CO��H2�ڴ��������·�Ӧ���ɼ״���ƽ��ʱ��Ӧ��������ֵ�Ũ�ȣ���ͼ��֪��P1ѹǿ�£�100��ʱ����ƽ��ʱCO��ת����Ϊ0.5���� CO��g��+2H2��g��?CH3OH��g����
��ʼ��mol/L����$\frac{a}{V}$ 2 $\frac{a}{V}$ 0
�仯��mol/L����0.5$\frac{a}{V}$ $\frac{a}{V}$ 0.5$\frac{a}{V}$
ƽ�⣨mol/L����0.5$\frac{a}{V}$ $\frac{a}{V}$ 0.5$\frac{a}{V}$
����ƽ�ⳣ��k=$\frac{c��CH{\;}_{3}OH��}{c��CO��c{\;}^{2}��H{\;}_{2}��}$=$\frac{0.5\frac{a}{V}}{0.5\frac{a}{V}��\frac{a{\;}^{2}}{V{\;}^{2}}}$=$\frac{V{\;}^{2}}{a{\;}^{2}}$����Ӧ��ƽ�ⳣ��Ϊ $\frac{V{\;}^{2}}{a{\;}^{2}}$��
�ʴ�Ϊ��$\frac{V{\;}^{2}}{a{\;}^{2}}$��
��5�����ݵ�������ͼ�з�Ӧ��������ͭ�缫ΪCO2�õ��ӷ�����ԭ��Ӧ����CH4���缫��ӦʽΪCO2+8e-+8H+=CH4+2H2O���ʴ�Ϊ��CO2+8e-+8H+=CH4+2H2O��
���� ���⿼��ռ乹�͵��жϡ���ѧ����ʽ����д����˹���ɡ��绯ѧԭ������ѧ��Ӧƽ���ƶ���ƽ�ⳣ���ȣ��Ѷ��еȣ�ע������ʽ��ƽ������ⷨ�����ã�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͨʽ��ͬ�IJ�ͬ����һ������ͬϵ�� | |
| B�� | ��ȫȼ��ij�л������CO2��H2O�����ʵ���֮��Ϊ1��1�����л���ֻ������ϩ�������� | |
| C�� | ����ʽ��ͬ���ṹ��ͬ�Ļ�����һ����Ϊͬ���칹�� | |
| D�� | ����ͨʽCnH2n-2���л���һ����Ȳ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
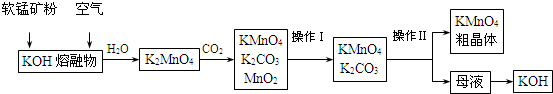
| ʵ�鷽�� | ʵ�������� |
| ȡ�������������Թ��У���ˮ�ܽ�μ�����ϡ���� | ������ɫ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ��� | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
| ��������/% | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.61 |
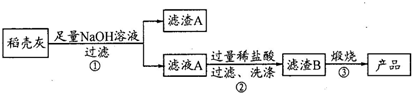
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
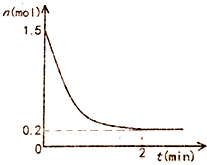 ��һ����̶�Ϊ10L���ܱպ��������г���1.5mol������������Ӧ��2NH3��g��?N2��g��+3H2��g����H=93KJ/mol��Ӧ������NH3���ʵ�����ʱ��ı仯��ͼ��ʾ��
��һ����̶�Ϊ10L���ܱպ��������г���1.5mol������������Ӧ��2NH3��g��?N2��g��+3H2��g����H=93KJ/mol��Ӧ������NH3���ʵ�����ʱ��ı仯��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������Ӧ�ﵽƽ����������������������£�ֻ�ı�ѹǿ��ƽ�ⲻ�ƶ� | |
| B�� | �÷�Ӧ�Ļ�ѧƽ�ⳣ��ΪK=$\frac{c��C��{c}^{3}��D��{c}^{4}��E��}{c��A��c��B��}$ | |
| C�� | E���� | |
| D�� | �÷�Ӧ���Ȼ�ѧ����ʽ 2A��g��+B��g��?C��g��+3D��l��+4E��g����H=-QkJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 100mL 0.5 mol/L MgCl2��Һ | B�� | 200mL 0.25 mol/L KCl��Һ | ||
| C�� | 100mL 0.5 mol/L HCl��Һ | D�� | 100mL 0.5 mol/L NaClO��Һ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com