
【题目】碳酸铈[Ce2(CO3)3]是制备稀土发光材料、汽车尾气净化催化剂的重要原料。碳酸铈可由铈的氯化物和碳酸氢铵反应制备。甲同学利用下列装置模拟制备Ce2(CO3)3:
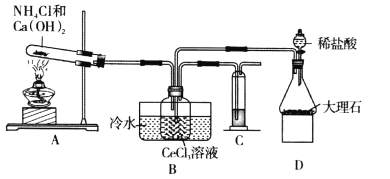
已知:i.装置C中溶液为亚硫酸钠溶液;
ii.Ksp[Ce2(CO3)3]=1.00×10-28;
iii.Ce3+易被空气氧化成Ce4+。
(1)装置D中盛放稀盐酸的实验仪器名称为________,装置C中溶液的作用是________。
(2)装置A中发生的化学反应方程式为________。
(3)实验装置中有一处不合理,请针对不合理之处写出改进措施:________。
(4)装置B中制备Ce2(CO3)3反应的离子方程式为________。
(5)实验过程中当Ce3+沉淀完全时![]() ,溶液中
,溶液中![]() 为________。
为________。
(6)Ce2(CO3)3在装置B中沉淀,然后经过静置、过滤、洗涤、干燥后即可得到产品。检验产品是否洗涤干净的方法为________。
(7)为测定产品中Ce2(CO3)3的纯度,取![]() 产品加入稀硫酸、
产品加入稀硫酸、![]() 溶液至全部溶解,配成
溶液至全部溶解,配成![]() 溶液,取
溶液,取![]() 溶液用
溶液用![]() 的
的![]() 溶液滴定至终点(铈被还原成Ce3+),消耗
溶液滴定至终点(铈被还原成Ce3+),消耗![]() 溶液
溶液![]() ,则产品中Ce2(CO3)3的纯度为________。
,则产品中Ce2(CO3)3的纯度为________。
【答案】分液漏斗 防止空气中的氧气进入装置B中氧化Ce3+ 2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑ 装置BD之间连接饱和碳酸氢钠溶液,吸收挥发出来的HCl气体 2Ce3++6HCO3-=Ce2(CO3)3↓+3CO2↑+3H2O 10-6mol/L 取最后一次洗涤后的滤液少许于试管中,加入少量硝酸银溶液,如无沉淀产生,则证明已经洗涤干净 92.00%
CaCl2+2H2O+2NH3↑ 装置BD之间连接饱和碳酸氢钠溶液,吸收挥发出来的HCl气体 2Ce3++6HCO3-=Ce2(CO3)3↓+3CO2↑+3H2O 10-6mol/L 取最后一次洗涤后的滤液少许于试管中,加入少量硝酸银溶液,如无沉淀产生,则证明已经洗涤干净 92.00%
【解析】
碳酸铈可由铈的氯化物和碳酸氢铵反应生成Ce2(CO3)3,则装置A中生成的NH3通入盛装CeCl3溶液的广口瓶中时,同时要通入过量装置D中制得的CO2,方可制得Ce2(CO3)3;操作过程中需要注意除去CO2中混有的HCl,洗涤Ce2(CO3)3时只要最后一次洗涤液中检验不到Cl-即为洗涤干净。
(1)装置D中盛放稀盐酸的实验仪器名称为分液漏斗,装置C中溶液为亚硫酸钠溶液,有较强还原性,能防止空气中的氧气进入装置B中氧化Ce3+;
(2)装置A是制氨气,发生的化学反应方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑;
CaCl2+2H2O+2NH3↑;
(3) CO2中混有的HCl,需要在装置BD之间连接饱和碳酸氢钠溶液,吸收挥发出来的HCl气体;
(4)装置B中CeCl3溶液和碳酸氢铵反应生成Ce2(CO3)3,发生反应的离子方程式为2Ce3++6HCO3-=Ce2(CO3)3↓+3CO2↑+3H2O;
(5)已知Ksp[Ce2(CO3)3]=c2(Ce3+)×c3(CO32-)=1.00×10-28,且c (Ce3+)=1×10-5mol/L,则![]() =
=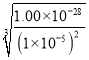 mol/L=1×10-6mol/L;
mol/L=1×10-6mol/L;
(6)最初沉淀Ce2(CO3)3的洗涤液中含有Cl-,当取最后一次洗涤后的滤液少许于试管中,加入少量硝酸银溶液,如无沉淀产生,则证明已经洗涤干净;
(7)已知滴定时发生反应为Ce4++Fe2+=Ce3++Fe3+,消耗![]() 的
的![]() 溶液20.00mL,即参加反应的Fe2+的物质的量为0.02L×0.10mol/L=2×10-3mol,则产品中Ce2(CO3)3的纯度为
溶液20.00mL,即参加反应的Fe2+的物质的量为0.02L×0.10mol/L=2×10-3mol,则产品中Ce2(CO3)3的纯度为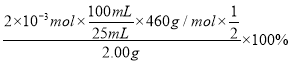 =92.00%。
=92.00%。


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】下列溶液中物质的量浓度为1mol/L的是( )
A.将40g NaOH溶解在1L水中
B.将22.4L HCl气体溶于水配成1L溶液
C.将1L 10 mol/L浓盐酸加入9L水中
D.将10g NaOH溶于少量水,在稀释到溶液为250ml
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油炼制过程中产生的H2S是一种有毒气体,其有效利用是亟需解决的问题。
(1)H2S的电子式是_________。
(2)热分解法处理H2S
H2S(g)=H2(g)+S(s) ΔH1
已知:i.2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH2
ii.S(s)+O2(g)=SO2(g) ΔH3
①利用ΔH2和ΔH3计算ΔH1时,还需要利用_______反应的ΔH。
②直接加热分解H2S转化率低,科学家发现MoS2可以催化H2S分解制取氢气和硫磺,多孔陶瓷膜可以使氢气选择性分离。科学家使用沉积有MoS2的多孔陶瓷膜装置进行反应的原因有_________。
(3)电化学法处理H2S
为避免硫磺沉积在阳极,将氧化吸收和电解制氢过程分开进行,装置如图所示。氧化吸收器中为Fe2(SO4)3溶液,电解反应器中,以石墨为阳极,以Pt为阴极,中间用质子交换膜隔开。
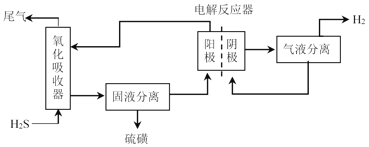
①氧化吸收器中反应的离子方程式为_________。
②电解反应器中,阴极的电极反应式为_________。
③电解反应器的作用是_________(写出2点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3+与SO32-不能大量共存的原因是存在氧化还原反应和双水解反应之争。如图是利用手持技术测量向FeCl3溶液滴加Na2SO3溶液过程中的pH和电导率的变化情况:
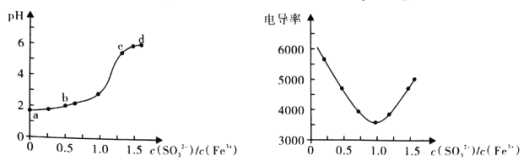
实验过程还发现:
i.b点时溶液澄清透明,向其中分别加入KSCN溶液和NaOH溶液,现象分别为出现血红色和灰绿色难溶物;
ii.c点和d点均出现明显红褐色难溶物,取上层清液,分别加入KSCN溶液和NaOH溶液,现象分别为出现血红色和无明显变化。
结合以上信息,下列分析不合理的是
A.a点溶液在配置时需加入盐酸
B.结合b点附近pH的变化以及实验现象,说明此处发生了氧化还原反应
C.c点溶液中发生的主要反应为2Fe3++3SO32-+6H2O=2Fe(OH)3↓+3H2SO3
D.取d点处上层清液,向其中滴加K3[Fe(CN)6],溶液会出现蓝色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在课堂上,老师展示了两瓶失去标签的Na2CO3和 NaHCO3无色饱和溶液,希望班里同学提出简便的鉴别方法,该班同学踊跃提出方法。其中不合理的是( )
①取等量的溶液于两支试管中,各滴入酚酞试液,红色较深的是Na2CO3
②取等量的溶液于两支试管中,加热,有气泡产生的是NaHCO3
③取等量的溶液于两支试管中,逐滴加入稀盐酸,开始就有气体放出的是NaHCO3
④取等量的溶液于两支试管中,滴加BaCl2溶液,生成白色沉淀的是Na2CO3
⑤取等量的溶液于两支试管中,滴加Ba(OH)2溶液,生成白色沉淀的是Na2CO3
A.①B.②⑤C.③④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿(FeS2)催化氧化的化学方程式为:2FeS2+7O2+2H2O 2FeSO4+2H2SO4。已知NA是阿伏加德罗常数的值,下列说法正确的是
2FeSO4+2H2SO4。已知NA是阿伏加德罗常数的值,下列说法正确的是
A.FeSO4和H2SO4都是离子化合物,均属于强电解质
B.0.1 mol·L-1 FeSO4 溶液中Fe2+离子的浓度为0.1 mol·L-1
C.FeSO4既是被氧化得到的产物,又是被还原得到的产物
D.当转移2 mol电子时,消耗氧气的体积(标准状况)约为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:

Ⅰ.若X、Y是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞。
(1)写出电解饱和食盐水的离子方程式____;
(2)在X极附近观察到的现象是____。
Ⅱ.若用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
(1)X电极电极反应式是____,Y电极的材料是___;
(2)当电路中有0.04mol电子通过时,阴极增重___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A.焊接铁轨: 2Fe + Al2O3![]() 2Al + Fe2O3
2Al + Fe2O3
B.工业固氮: N2 + 3H2![]() 2NH3
2NH3
C.用纯碱除油污:CO32-+H2O![]() HCO3-+ OH-
HCO3-+ OH-
D.用湿润的淀粉KI试纸检验Cl2:Cl2 + 2I-=2Cl-+I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是
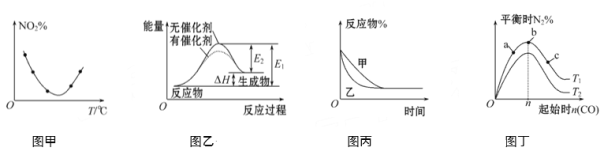
A. 图甲表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)![]() N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH<0
B. 图乙表示的反应是吸热反应,该图表明催化剂不能改变化学反应的焓变
C. 图丙表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(g)的影响,则P乙>P甲
3C(g)+D(g)的影响,则P乙>P甲
D. 图丁表示反应:4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ΔH<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,平衡常数K1>K2
N2(g)+4CO2(g) ΔH<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,平衡常数K1>K2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com