
下图是某溶液在稀释过程中,溶质的物质的量浓度随溶液体积的变化曲线图,根据图中数据分析可得出a值等于
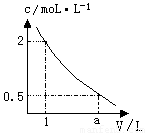
A.2 B.3 C.4 D.5
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:阅读理解
例某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示的装置先进行了有关实验:
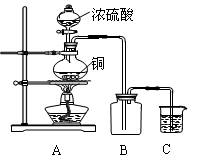
⑴B是用来收集实验中产生的装置,但未将导管画全,请将装置图补充完整。
⑵实验中他们取6.4g铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜与浓硫酸反应的化学方程式
②为什么有一定量的余酸但未能使铜片完全溶解?你认为原因是 。
③下列试剂中能够证明反应结束后的烧瓶中确有余酸的是 (填写字母编号)
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(3)为了测定余酸的物质的量浓度,甲、乙两位同学进行了如下设计:
①甲同学设计方案是:
先测定铜与浓硫酸反应产生的SO2的量,再计算余酸的物质的量浓度,他认为测定SO2的量的方法有很多种,请问下列实验方案中不可行的是 (填写字母编号)
A:将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B:将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称量沉淀
C:用排水法测定装置A产生气体的体积(已折算成标准状况)
D:将装置A产生的气体缓缓通入足量的氢氧化钡溶液(预先除去了溶解O2),反应完全后,过滤、洗涤、干燥,称量沉淀(隔绝空气条件下)
②乙同学设计的方案是:
在反应后的溶液中加蒸馏水稀释至1000mL,取20mL于锥形瓶中,滴加2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知:Cu(OH)2开始沉淀的pH约为5),通过测定出消耗NaOH溶液的体积来求余酸的物质的量浓度。假定反应前后烧瓶中溶液体积不变,你认为乙同学设计的实验方案能否求得余酸的物质的量浓度 ,(填能或否),其理由是 。
(4)请你再设计一个可行的实验方案来测定余酸的物质的量浓度。简要写出操作步骤及需要测定的数据,并写出相应的计算式。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖北省武汉市五校高一上学期期中统考化学试卷(带解析) 题型:实验题
(14分)I.在化学实验时必须注意安全操作,避免意外伤害,下列实验操作或事故处理不正确的是 ( )
①在点燃易燃气体前,必须检验气体的纯度
②在稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水中,并用玻璃棒搅拌
③浓硫酸对皮肤有腐蚀性,如不慎沾到皮肤上,应用较多的水冲洗,再涂上硼酸稀溶液
④给试管中的液体加热时,液体不超过试管容积的1/3
⑤点燃添满酒精的酒精灯
⑥实验时不慎被玻璃划破手指,引起轻微流血时,用三氯化铁溶液涂抹止血(血液可看作是胶体分散系)
II.某同学用胆矾晶体(CuSO4·5H2O )配制0.40mol/L的CuSO4溶液240mL,回答下列问题
(1)所需仪器为:托盘天平、药匙、烧杯、胶头滴管 ,还需要哪些玻璃仪器才能完成该实验,请写出: 。
(2)请写出该实验的简要的实验步骤:
①计算 ②称量胆矾 g ③ ④转移 ⑤洗涤并转移 ⑥定容 ⑦摇匀
(3)下图是该同学转移溶液的示意图,图中的错误是 。
(4)该同学在定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响 (填“偏高”、“偏低”或“无影响”)。
(5)一瓶配制好的稀CuSO4溶液,因时间过长,标签污损,为检验它就是盛有CuSO4溶液,说说你的实验检验方法。
| 鉴别对象 | 实验操作、现象 |
| Cu2+ | |
 | |
查看答案和解析>>
科目:高中化学 来源:2014届湖北省武汉市五校高一上学期期中统考化学试卷(解析版) 题型:实验题
(14分)I.在化学实验时必须注意安全操作,避免意外伤害,下列实验操作或事故处理不正确的是 ( )
①在点燃易燃气体前,必须检验气体的纯度
②在稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水中,并用玻璃棒搅拌
③浓硫酸对皮肤有腐蚀性,如不慎沾到皮肤上,应用较多的水冲洗,再涂上硼酸稀溶液
④给试管中的液体加热时,液体不超过试管容积的1/3
⑤点燃添满酒精的酒精灯
⑥实验时不慎被玻璃划破手指,引起轻微流血时,用三氯化铁溶液涂抹止血(血液可看作是胶体分散系)
II.某同学用胆矾晶体(CuSO4·5H2O )配制0.40mol/L的CuSO4溶液240mL,回答下列问题
(1)所需仪器为:托盘天平、药匙、烧杯、 胶头滴管 ,还需要哪些玻璃仪器才能完成该实验,请写出: 。
(2)请写出该实验的简要的实验步骤:
①计算 ②称量胆矾 g ③ ④转移 ⑤洗涤并转移 ⑥定容 ⑦摇匀
(3)下图是该同学转移溶液的示意图,图中的错误是 。

(4)该同学在定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响 (填“偏高”、“偏低”或“无影响”)。
(5)一瓶配制好的稀CuSO4溶液,因时间过长,标签污损,为检验它就是盛有CuSO4溶液,说说你的实验检验方法。
|
鉴别对象 |
实验操作、现象 |
|
Cu2+ |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源:同步题 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:
(1)用5.0 mol·L-1的NaOH溶液配制0.1 mol·L-1的NaOH溶液时,下图所示的仪器中,肯定不需要的是 (填序号),配制上述溶液还需要的玻璃仪器是 (填仪器名称)
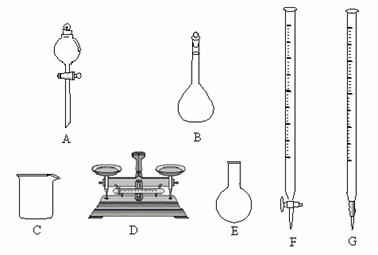
(2)在配制过程中下列操作将导致实际所配NaOH溶液浓度偏低的是(填编号)
①准确取出浓NaOH溶液在空气中露置时间过长;
②用容器将浓NaOH溶液直接加入容量瓶,缓慢加入蒸馏水至液面最低点恰好和环形刻度线相切;
③摇匀后,液面低于刻度线,再加蒸馏水至液面最低点恰好和环形刻度线相切;
④稀释NaOH溶液的仪器未洗涤。
(3)现欲配制500mL 0.1 mol·L-1的NaOH溶液,需要 mL 5.0 mol·L-1的NaOH溶液,
需要 的容量瓶。
(4)若配制溶液时需要用固体NaOH,则需要NaOH的质量为 。某同学实际配置的NaOH溶液的浓度为0.08 mol·L-1,原因可能是以下 (填编号)
A:使用滤纸称量氢氧化钠固体 B:容量瓶中原来存有少量水
C:溶解后的烧杯未经多次洗涤 D:胶头滴管加水后定容时仰视刻度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com