
| A. | 8.2mL和1.8mL | B. | 5.6mL和4.4mL | C. | 6.4mL和3.6mL | D. | 3.5mL和6.5mL |
分析 先判断过量的气体的成分,若剩余气体为氧气,然后根据 4NO2+O2+2H2O=4HNO3计算,求出参加此反应的NO2和O2,最后相加得到原来的氧气;若剩余气体为NO,先根据3NO2+H2O=2HNO3+NO求出过量的NO2,然后根据4NO2+O2+2H2O=4HNO3求出参加此反应的NO2和O2,最后相加得到原来的NO2,据此进行解答.
解答 解:NO2和O2混合气体的试管倒立于水中,发生反应为:4NO2+O2+2H2O=4HNO3 最后剩余气体可能为氧气,也可能是NO气体,
若剩余气体为O2,设参加反应4NO2+O2+2H2O=4HNO3消耗的氧气为x,则有消耗的NO2为4x,即:5x=8mL,x=1.6mL,原混合气体中氧气体积为:1.6mL+2mL=3.6mL,V(NO2)=10mL-3.6mL=6.4mL;
若剩余气体为NO气体,则有3NO2+H2O=2HNO3+NO,说明过量的NO2为2mL×3=6mL,反应4NO2+O2+2H2O=4HNO3消耗的气体总体积为:10mL-6mL=4mL,设反应消耗的氧气体积为y,消耗的NO2为4y,则:5y=4mL,y=0.8mL,即混合气体中氧气的体积为0.8mL,V(NO2)=10mL-0.8mL=9.2mL,
故选C.
点评 本题主要考查化学方程式的计算,题目难度中等,明确发生反应实质为解答关键,注意掌握讨论法在化学计算中的应用,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
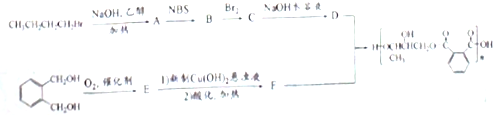

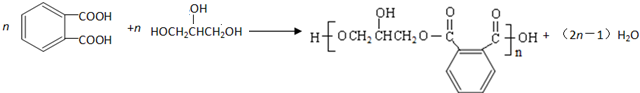
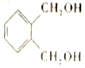 的符合下列条件的同分异构体有6 种(不考虑立体异构)
的符合下列条件的同分异构体有6 种(不考虑立体异构)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c1=2c2 | B. | c1>c2 | C. | c1=c2 | D. | c1<c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol | B. | 0.14mol | C. | 4g | D. | 5.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu和Mg | B. | Mg和Al | C. | Al 和 Si | D. | SiO2和Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
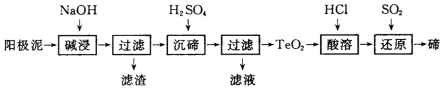
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
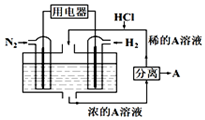 有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,制造出新型燃料电池,装置如图所示,下列有关说法正确的是( )
有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,制造出新型燃料电池,装置如图所示,下列有关说法正确的是( )| A. | 通入N2的一极为负极 | |
| B. | 通入H2的电极反应为:H2+2e-=2H+ | |
| C. | 物质A是NH4Cl | |
| D. | 反应过程中左边区域溶液pH逐渐减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com