
| 离子 | Cu2+ | Al3+ | NO3- | Cl- |
| 物质的量浓度(mol/L) | 1 | 1 | a | 1 |
| A. | 电解后溶液pH=0 | B. | a=3 | ||
| C. | 阳极生成1.5mol Cl2 | D. | 阴极析出的金属是铜与铝 |
分析 由溶液电荷守恒可知2c(Cu2+)+3c(Al3+)=c(NO3-)+c(Cl-),可求得c(NO3-)=4moL/L,
由于离子放电顺序Cu2+>H+>Al3+,Cl->OH->NO3-,电解时阳极首先发生:2Cl--2e-=Cl2↑,1mol氯离子放电转移1mol电子,然后发生4OH--4e-=O2↑+2H2O,阴极首先发生:Cu2++2e-=Cu,1molCu2+反应转移2mol电子,然后发生2H++2e-=H2↑,最后溶液中溶质为Al(NO3)、HNO3,根据电荷守恒计算溶液中c(H+),再根据pH=-lgc(H+)计算溶液pH值.
解答 解:由溶液电荷守恒可知2c(Cu2+)+3c(Al3+)=c(NO3-)+c(Cl-),则:2×1mol/L+3×1mol/L=+)=c(NO3-)+1mol/L,可求得c(NO3-)=4moL/L,
溶液中n(u2+)=n(Al3+)=n(Cl-)=1L×1mol/L=1mol,
离子放电顺序Cu2+>H+>Al3+,Cl->OH->NO3-,电解时阳极首先发生:2Cl--2e-=Cl2↑,1mol氯离子放电转移1mol电子,生成0.5mol氯气,然后发生4OH--4e-=O2↑+2H2O,生成氧气为$\frac{3mol-1mol}{4}$=0.5mol;
阴极首先发生:Cu2++2e-=Cu,1molCu2+反应转移2mol电子,然后发生2H++2e-=H2↑,最后溶液中溶质为Al(NO3)、HNO3.
A.根据电荷守恒,溶液中c(H+)+3c(Al3+)=c(NO3-),即c(H+)+3×1mol/L=4mol/L,故c(H+)=1mol/L,则pH=-lg1=0,故A正确;
B.由上述分析可知:a=4,故B错误;
C.阳极生成0.5mol氯气、0.5mol氧气,故C错误;
D.离子放电顺序Cu2+>H+>Al3+,没有Al生成,阴极析出的金属是铜,故D错误,
故选:A.
点评 本题考查电解原理及计算,侧重考查学生分析计算能力,关键是掌握离子放电顺序,A中注意利用守恒法计算氢离子浓度,避免利用电极反应式的繁琐,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:4 | C. | 1:2 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | A | B | C |
| 装置 | 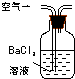 | 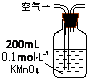 | 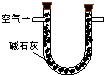 |
| 原理 | 通入V升空气,测定生成沉淀的质量 | 当KMnO4溶液刚好褪色时,测定通入空气的体积V | 通入V升空气,测定U型管增加的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 标准状况下,22.4LSO3含有NA个SO3分子 | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA | |
| D. | 56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ③ | C. | ①②③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.06mol/L | B. | 0.12mol/L | C. | 0.03mol/L | D. | 0.24mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 上述灼烧过程的尾气均可直接排到空气中 | |
| B. | 由6 mol CuFeS2生成6 mol Cu,上述共消耗15 mol O2 | |
| C. | 在反应2Cu2O+Cu2S═6Cu+SO2中,作氧化剂的只有Cu2O | |
| D. | 电解精炼时,粗铜应与外电源正极相连 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com