
| A. | 通过NaOH溶液后再通过浓硫酸 | B. | 通过CuSO4溶液后再通过石灰水 | ||
| C. | 通过P2O5后再通过固体NaOH | D. | 通过碱石灰 |
科目:高中化学 来源: 题型:选择题
| A. | 所含碳氢键数目为$\frac{a{N}_{A}}{7}$ | |
| B. | 常温常压,完全燃烧时消耗的O2一定是$\frac{33.6a}{14}$L | |
| C. | 所含共用电子对数目为($\frac{a}{7+1}$)NA | |
| D. | 所含原子总数为$\frac{a{N}_{A}}{14}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
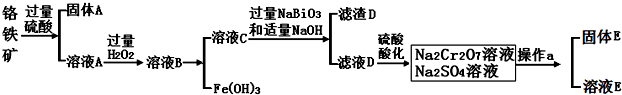
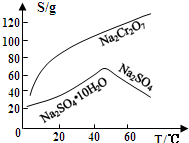

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
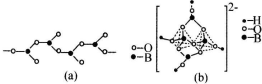
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液与NaOH溶液共热.产生能使湿润的红色石蕊试纸变蓝的气体,说明原溶液中存在NH4+ | |
| B. | 某溶液中加入盐酸后有无色气体产生,该气体能够使澄清的石灰水变浑浊,则原溶液中含CO32- | |
| C. | 用铂丝蘸取某溶液在酒精灯的火焰上灼烧时.火焰呈黄色,说明原溶液中只含有Na+,不含有K+ | |
| D. | 某溶液中加入BaCl2溶液时,产生白色沉淀,加稀硝酸沉淀不溶解,说明原溶液中存在SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
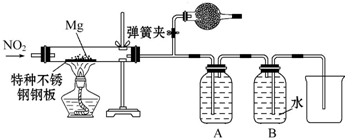
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
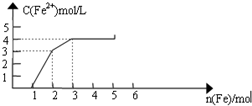 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则原溶液中Fe3+与NO3-物质的量浓度之比为( )
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则原溶液中Fe3+与NO3-物质的量浓度之比为( )| A. | 1:8 | B. | 1:9 | C. | 3:8 | D. | 1:11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com