
【题目】已知水在25℃和95℃时,其电离平衡曲线如右图所示:

(1)则25℃时水的电离平衡曲线应为__________(填“A”或“B”);
(2)25℃时,将![]() =11的NaOH溶液与
=11的NaOH溶液与![]() =4的
=4的![]() 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的![]() =9,则NaOH溶液与
=9,则NaOH溶液与![]() 溶液的体积比为____________;
溶液的体积比为____________;
(3)95℃时,若100体积![]() 1=
1=![]() 的某强酸溶液与1体积
的某强酸溶液与1体积![]() 2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的
2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的![]() 1与强碱的
1与强碱的![]() 2之间应满足的关系是_______。
2之间应满足的关系是_______。
【答案】 A 1:9 ![]() +b=14 或
+b=14 或![]() 1+
1+![]() 214
214
【解析】(1). 水的电离是吸热过程,升高温度,使水的电离程度增大,当温度升高时,促进水的电离,水的离子积增大,水中氢离子、氢氧根离子浓度都增大,水的pH减小,但溶液仍然呈中性,则25℃时水的电离平衡曲线应为A,故答案为A;
(2).据图可知,25℃时水的离子积常数Kw=1×10-14,则pH=11的NaOH溶液中c(OH)=103mol/L,pH=4的H2SO4溶液中(H+)=104mol/L,二者混合后所得溶液pH=9,说明碱过量,所得溶液中c(OH)=105mol/L,设碱的体积为x,酸的体积为y,则(103mol/L×x-104mol/L×y)÷(x+y)=105,解得x:y=1:9,故答案为:1:9;
(3). 95℃时,水的离子积常数为10-12,混合溶液呈中性,说明酸中氢离子的物质的量=碱中氢氧根离子的物质的量,即:10-amol/L×100=10b-12 mol/L×1,所以a+b=12+2=14,故答案为:a+b=14或pH1+pH2=14。


科目:高中化学 来源: 题型:
【题目】常温下,现向50 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.05 mol·L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生)。下列说法正确的是

A.b点溶液中离子浓度由大到小的顺序为:c(Na+)>c(SO![]() )>c(NH
)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.图中b、c、d三点溶液中水的电离程度最大的是c点
C.b点后滴加NaOH溶液过程中,NH3·H2O的电离程度逐渐减小
D.pH=7时,溶液中c(H+)+c(Na+)+c(NH![]() )=c(SO
)=c(SO![]() )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池在碱性环境下的总反应方程式为:4M+nO2+2nH2O=4M(OH)n。已知:电池的“理论比能量”指单位质量电极材料理论上释放出的最大电能。下列说法不正确的是( )
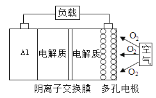
A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 比较Mg、Al、Zn三种金属-空气电池,Al-空气电池的理论比能量最高
C. M-空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
D. 消耗氧气22.4 L(标准状况),有4 molOH-从右往左通过阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,一定压强下的密闭容器中发生反应:aX(g)+bY(g) ![]() cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
A. 平衡正移 B. Z的体积分数变小
C. (a+b)>(c+d) D. X的转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是( )
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氢氧化铁
C. 电解法制取铝单质时也可以采用电解氯化铝以降低成本
D. 反应②的化学方程式为NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应处于平衡状态时,下列说法正确的是
A. 各组分浓度不再随时间而变化 B. 反应物浓度等于生成物浓度
C. 反应物质量等于生成物质量 D. 反应不再进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,与16g O2的体积相等的N2为( )
A.体积为22.4LB.分子数为6.02×1024
C.质量为14gD.物质的量为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是 ( )

A. 反应①为取代反应,有机产物的密度比水小
B. 反应③为取代反应,有机产物是一种烃
C. 反应②为氧化反应,反应现象是火焰明亮并带有较多的黑烟
D. 反应④1mol苯最多与3molH2发生加成反应,是因为苯分子含有三个碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基于CaSO4为载氧体的天然气燃烧是一种新型绿色的燃烧方式,CaSO4作为氧和热量的有效载体,能够高效低能耗地实现CO2的分离和捕获其原理如下图所示:
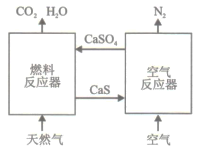
(1)已知在燃料反应器中发生如下反应:
i.4CaSO4(s)+CH4(g)=4CaO(s)+CO2(g)+4SO2(g)+2H2O(g) ΔH1=akJ/mol
ii.CaSO4(s)+CH4(g)=CaS(s)+CO2(g)+2H2O(g) ΔH2=bkJ/mol
ⅲ. CaS(s)+3CaSO4(s)= 4CaO(s)+4SO2(g) ΔH3=ckJ/mol
①燃料反应器中主反应为_________(填“i”“ii”或“ⅲ”)。
②反应i和ii的平衡常数Kp与温度的关系如图1,则a_______0(填“ >”“ =“或“<” );720℃时反应ⅲ的平衡常数Kp=________。

③下列措施可提高反应ii中甲烷平衡转化率的是_______。
A.增加CaSO4固体的投入量 B.将水蒸气冷凝
C.降温 D.增大甲烷流量
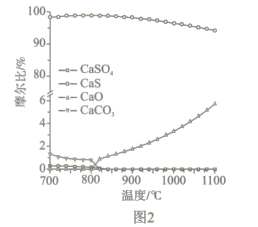
(2)如图2所示,该燃料反应器最佳温度范围为850℃ -900℃之间,从化学反应原理的角度说明原因:_______。
(3)空气反应器中发生的反应为
CaS(s) +2O2(g)=CaSO4(s) ΔH4=dkJ/mol
①根据热化学原理推测该反应为__________反应。
②在天然气燃烧过程中,可循环利用的物质为________。
(4)该原理总反应的热化学方程式为____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com