
 ,CO2
,CO2 .
. 分析 (1)一般来说,活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键;含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物;
(2)氯化铵为离子化合物,复杂阳离子和阴离子均需要括号;二氧化碳为共价化合物.
解答 解:(1)CaCl2只含有离子键;KOH既有离子键又有共价键;CO2只含有共价键;H2SO4只含有共价键;Na2O2既有离子键又有共价键;Na2S只含有离子键,
故答案为:CaCl2、KOH、Na2O2、Na2S;CO2、H2SO4;KOH、Na2O2;
(1)氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ,二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为:
,二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: ,故答案为:
,故答案为: ;
; .
.
点评 本题考查了离子键和共价键的判断和电子式的书写,题目难度中等,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:解答题
| X | Y | Z | |
| W |
 (1)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为
(1)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能自发进行的氧化还原反应,也可以通过电解来实现 | |
| B. | 电解质溶液导电是化学变化,金属导电是物理变化 | |
| C. | 电解池和原电池中均发生氧化还原反应 | |
| D. | 电解、电离、原电池均需要通电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| B. | 氮的固定只有在高温、高压、催化剂的条件下才能实现 | |
| C. | 服用铬含量超标的药用胶囊会对人体健康不会造成危害 | |
| D. | 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
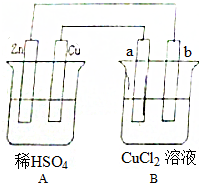
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
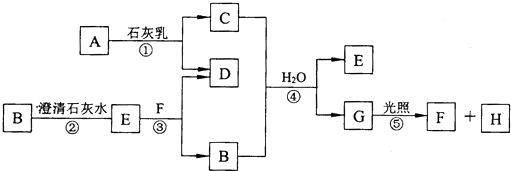
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com