
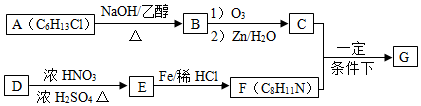
 $→_{②Zn/H_{2}O}^{①O_{3}}$R1CHO+
$→_{②Zn/H_{2}O}^{①O_{3}}$R1CHO+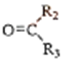
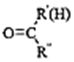 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$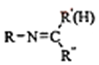 +H2O
+H2O .
. (写出其中一种的结构简式).
(写出其中一种的结构简式). $\stackrel{一定条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件}^{C}$J$\stackrel{还原}{→}$
$\stackrel{一定条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件}^{C}$J$\stackrel{还原}{→}$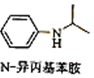
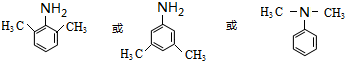
分析 A的分子式为C6H13Cl,为己烷的一氯代物,在氢氧化钠醇溶液、加热条件下发生消去反应得到B为烯烃,1mol B发生信息①中氧化反应生成2mol C,且C不能发生银镜反应,B为对称结构烯烃,且不饱和C原子没有H原子,故B为(CH3)2C=C(CH3)2,C为(CH3)2C=O,逆推可知A为(CH3)2CH-CCl(CH3)2.D属于单取代芳烃,其相对分子质量为106,D含有一个苯环,侧链式量=106-77=29,故侧链为-CH2CH3,D为 ,核磁共振氢谱显示F苯环上有两种化学环境的氢,故D发生乙基对位取代反应生成E为
,核磁共振氢谱显示F苯环上有两种化学环境的氢,故D发生乙基对位取代反应生成E为 ,由F的分子式可知,E中硝基被还原为-NH2,则F为
,由F的分子式可知,E中硝基被还原为-NH2,则F为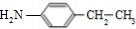 ,C与F发生信息⑤中反应,分子间脱去1分子水形成N=C双键得到G,则G为
,C与F发生信息⑤中反应,分子间脱去1分子水形成N=C双键得到G,则G为 ,以此解答(1)~(4);
,以此解答(1)~(4);
(5)由苯及化合物C经如下步骤可合成N-异丙基苯胺的流程可知,H为硝基苯,I为苯胺,C为(CH3)2C=O,J为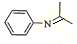 ,以此来解答.
,以此来解答.
解答 解:(1)C为(CH3)2C=O,官能团名称为羰基,D为 ,其化学名称为乙苯,
,其化学名称为乙苯,
故答案为:羰基;乙苯;
(2)由A生成B的化学方程式为(CH3)2CH-CCl(CH3)2+NaOH$→_{△}^{乙醇}$(CH3)2C=C(CH3)2+NaCl+H2O,属于消去反应,
故答案为:(CH3)2CH-CCl(CH3)2+NaOH$→_{△}^{乙醇}$(CH3)2C=C(CH3)2+NaCl+H2O;消去反应;
(3)由上述分析可知,G的结构简式为 ,
,
故答案为: ;
;
(4)F为 ,含有苯环同分异构体中,
,含有苯环同分异构体中,
若取代基为氨基、乙基,还有邻位、间位2种,
若只有一个取代基,可以为-CH(NH2)CH3、-CH2CH2NH2、-NH-CH2CH3、-CH2NHCH3、-N(CH3)2,有5种;
若取代为2个,还有-CH3、-CH2NH2或-CH3、-NHCH3,各有邻、间、对三种,共有6种;
若取代基有3个,即-CH3、-CH3、-NH2,2个甲基相邻,氨基有2种位置,2个甲基处于间位,氨基有3种位置,2个甲基处于对位,氨基有1种位置,共有2+3+1=6种,
故符合条件的同分异构体有:2+5+6+6=19,
其中核磁共振氢谱为4组峰,且面积比为6:2:2:1,说明含有2个-CH3,可以是 ,
,
故答案为:19; ;
;
(5)由苯与浓硝酸、浓硫酸在加热50℃~60℃条件下得到H为硝基苯,硝基苯在Fe粉/盐酸条件下还有得到I为 ,再与(CH3)2C=O反应得到
,再与(CH3)2C=O反应得到 ,最后加成反应还原得到
,最后加成反应还原得到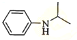 ,
,
故反应条件1所选用的试剂为:硝酸、浓硫酸、加热50℃~60℃,H为硝基苯,I的结构简式为 ,可知H→I的反应类型为还原反应,
,可知H→I的反应类型为还原反应,
故答案为:硝酸、浓硫酸、加热50℃~60℃;还原反应.
点评 本题考查有机物的合成,为高频考点,把握流程中官能团的变化、碳链变化、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度中等.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数ω(Na2CO3),称取此混合物mg,溶于水中,配成溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数ω(Na2CO3),称取此混合物mg,溶于水中,配成溶液.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Mg2+ | 8.1 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

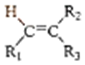
 以上R、R′、R″代表烃、烷基或芳基等)
以上R、R′、R″代表烃、烷基或芳基等)
 ,则与F具有相同官能团的同分异构体共5种(考虑顺反异构,不包含F).
,则与F具有相同官能团的同分异构体共5种(考虑顺反异构,不包含F). ,反应类型为消去反应.
,反应类型为消去反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A的单质的熔点最高 | B. | B元素的非金属性最强 | ||
| C. | C的简单离子半径最小 | D. | D的原子半径最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常量组分分析 | B. | 微量组分分析 | C. | 痕量组分分析 | D. | 超痕量组分分析 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 和水反应:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 硫酸铜溶液与氢氧化钡反应:SO42-+Ba2+═BaSO4↓ | |
| C. | 氯化亚铁溶液中通足量Cl2: Cl2+Fe2+═Fe3++2Cl- | |
| D. | 碳酸氢钙溶液和少量的澄淸石灰水混合:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com