
【题目】常温下,NCl3是一种黄色黏稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示装置制备NCl3。下列说法正确的是
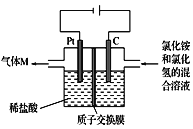
A.每生成1 mol NCl3,理论上有4 mol H+经质子交换膜从右侧向左侧迁移
B.石墨极的电极反应式为NH4++3Cl--6e-==NCl3+4H+
C.可用湿润的淀粉-KI试纸检验气体M
D.电解过程中,质子交换膜右侧溶液的pH会减小
【答案】B
【解析】
由电池的正负极可判断,C电极为阳极,Pt电极为阴极。在C电极,发生反应NH4++3Cl--6e-==NCl3+4H+;在Pt电极,6H++6e-==3H2↑。
A.依据电荷守恒,在阳极区,每生成1 mol NCl3,理论上有6 mol H+经质子交换膜从右侧向左侧迁移,A不正确;
B.根据以上分析,在阳极(石墨极),NH4+失电子后生成的物质与Cl-作用生成NCl3,电极反应式为NH4++3Cl--6e-==NCl3+4H+,B正确;
C.气体M为H2,不能用湿润的淀粉-KI试纸检验,C不正确;
D.电解过程中,质子交换膜右侧溶液中每生成4molH+,将有6molH+通过质子交换膜向阴极区移动,所以pH会增大,D不正确;
故选B。


科目:高中化学 来源: 题型:
【题目】浓度为0.1 mol/L的HCl溶液V mL,加水稀释到2V mL,再取出10 mL,这10 mL溶液中c(H+)为
A.0.1 mol/LB.0.01 mol/LC.0.02 mol/LD.0.05 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,水只作为还原剂的是( )
A.3Fe+4H2O(g)![]() Fe3O4+4H2B.2H2O
Fe3O4+4H2B.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C.2Na2O2+2H2O═4NaOH+O2↑D.2F2+2H2O═4HF+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学通过查询资料知道,一定浓度的硝酸与镁反应时,可得到二氧化氮、一氧化氮、氮气三种气体。该同学用下列仪器组装装置来直接验证有二氧化氮、一氧化氮生成并制取氮化镁 (假设实验中每步转化均是完全的) 。查阅文献得知:
①二氧化氮沸点为21.1 ℃、熔点为-11 ℃,一氧化氮沸点为-151 ℃、熔点为-164 ℃;
②镁也能与二氧化碳反应;
③氮化镁遇水反应生成氢氧化镁和氨气。
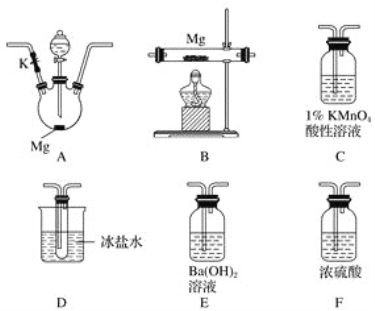
(1)实验中先打开开关K,通过导管向装置内通入二氧化碳气体以排出装置内的空气,停止通入二氧化碳的标志是________________________________。
(2)为实现上述实验目的,所选用的仪器的正确连接方式是A→____________→E,确定还原产物中有二氧化氮的现象是______________________________________,实验中要多次使用装置F,第二次使用F的目的是______________________________________________。
(3)实验过程中,发现在D中产生预期现象的同时,C中溶液颜色慢慢褪去,试写出C中反应的离子方程式:________________________________。
(4)甲同学在A中开始反应时,马上点燃B处的酒精灯,实验结束后通过测试发现B处的产品纯度不高,原因是______________________________________。
(5)设计一种实验方案,验证镁与硝酸反应时确实有氮气生成:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表的一部分,其中A、B、C、D、E代表元素。下列说法错误的是
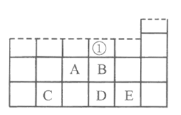
A.元素B、D对应族①处的标识为ⅥA16
B.熔点:D的氧化物<C的氧化物
C.AE3分子中所有原子都满足8电子稳定结构
D.E的含氧酸酸性强于D的含氧酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有三个不成对的电子;C元素可分别与A、B、D生成RC2型化合物,其中的DC2与C3互为等电子体。下列叙述中不正确的是
A. D原子的简化电子排布式为[Ar]3s23p4
B. B、C两元素的第一电离能大小关系为B>C
C. 用电子式表示AD2的形成过程为![]()
D. 由B60分子形成的晶体与A60相似,分子中总键能:B60>A60
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物X,含有![]() 、
、![]() 、
、![]() 和
和![]() 中的几种,进行如下实验:
中的几种,进行如下实验:
①X与水作用有气泡冒出,得到有色沉淀Y和弱碱性溶液Z;
②沉淀Y与![]() 溶液作用,无变化。
溶液作用,无变化。
下列说法不正确的是( )
A.混合物X中必定含有![]() ,不含
,不含![]()
B.溶液Z中溶质主要是钠盐,且必含![]()
C.灼烧沉淀Y,可能得到黑色物质
D.往溶液Z中加入Cu粉,若不溶解,说明X中不含![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2=NH4BO2+4H2O。已知两极室中电解质足量,下列说法正确的是( )
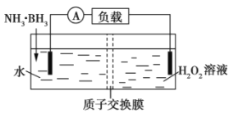
A.正极的电极反应式为2H++2e-═H2↑
B.电池工作时,H+通过质子交换膜向负极移动
C.电池工作时,正、负极分别放出H2和NH3
D.工作一段时间后,若左右两极室质量差为1.9g,则电路中转移0.6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族元素原子中最小的,B的最高价氧化物对应水化物的化学式为![]() ;C元素原子的最外层电子数比次外层电子数多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物
;C元素原子的最外层电子数比次外层电子数多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物![]() ;C、E同主族。
;C、E同主族。
(1)D在周期表中的位置为______;B的原子结构示意图为______。
(2)E元素形成的最高价氧化物对应水化物的化学式为______。
(3)元素C、D、E的原子半径大小关系是______(用元素符号表示)。
(4)C、D可形成化合物![]() ,
,![]() 含有的化学键是______。
含有的化学键是______。
(5)A、C两种元素形成的原子个数比为1:1的化合物的电子式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com