
【题目】燃煤废气中的氮氧化物(NOx)、CO2、SO2等气体,常用下列方法处理,以实现节能减排、废物利用等。已知:25℃ 时,Kb(NH3·H2O)=1.8×10-5; H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7。
(1)处理烟气中的SO2常用液吸法。室温条件下,将烟气通入浓氨水中得到(NH4)2SO3溶液,0.1mol/L(NH4)2SO3溶液的pH____(填“>”“<”或“=”)7。
(2)用活性炭可以还原处理氮氧化物,有关反应为C(s)+2NO(g) N2(g)+CO2(g)。在恒容条件下,能判断该反应一定达到平衡状态的依据是 ________(填选项编号)。
A.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
B.混合气体的密度不再发生改变
C.反应体系的压强不再发生改变
D.混合气体的平均相对分子质量不再改变
(3)有科学家经过研究发现,用CO2和H2在210~290℃,催化剂条件下可转化生成甲醇蒸气和水蒸气。
①230℃,向容器中投入0.5molCO2和1.5molH2,当转化率达80% 时放出热量19.6kJ能量,写出该反应的热化学方程式__________________。
②一定条件下,往 2L恒容密闭容器中充入1.0molCO2和3.0molH2,在不同催化剂作用下,相同时间内 CO2的转化率随温度的变化如图1所示:

催化剂效果最佳的是催化剂________(填“Ⅰ”“Ⅱ”“Ⅲ”)。b点v( 正 )________v( 逆 )( 填“>”“<”或“=”) 。此反应在 a 点时已达平衡状态,a 点的转化率比 c 点高的原因_____。已知容器内的起始压强为100kPa,则图中c点对应温度下反应的平衡常数Kp=____________KPa-2 。(保留两位有效数字,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)
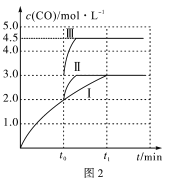
(4)一定条件下,CO2和H2也可以发生反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH<0,一定温度下,在3L容积可变的密闭容器中发生如上反应,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ或曲线Ⅲ。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是____________________。
【答案】> BD CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=-49kJ/mol I > 该反应为放热反应,温度升高,平衡逆向移动 8.3×10-4 将容器快速压缩至2L
【解析】
(1)(NH4)2SO3溶液中存在NH4+和SO32-的水解,结合NH3H2O和H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7分析水解能力的大小,判断溶液的酸碱性;
(2)恒容条件下,反应达到平衡的标志依据“变量不变”方法判断,正逆反应速率相同,各组分含量保持不变;
(3)①根据图1可知0.5mol CO2和1.5mol H2转化率达80%时放热23-3.4=19.6KJ,然后按比例计算:CO2(g)+3H2(g)CH3OH(g)+H2O(g)的△H得出该反应的热化学方程式;②由图象知:反应Ⅰ在较低温度T3时CO2就达到80%的转化率,故催化剂效果最佳的反应是反应Ⅰ;T3的b点时,反应未达到限度,故v(正)>v(逆);该反应为放热反应,T4反应已经达到平衡,升高温度到T5平衡向逆反应移动,从而使CO2的转化率降低。故T4的a点转化率比T5的c点高; c点时,
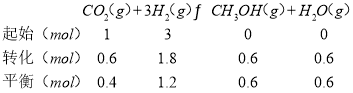
代入平衡常数表达式计算;
(4)当曲线Ⅰ变为曲线Ⅲ时一氧化碳物质的量浓度增大,反应是气体体积不变的反应,可变容器中气体体积和浓度成反比,气体物质的量不变。
(1)已知NH3H2O的电能平衡常数大于H2SO3的Ka2,则在(NH4)2SO3溶液中NH4+的水解能力小于SO32-的水解程度,可知溶液显碱性,即pH>7;
(2)在恒容条件下,能判断该反应一定达到化学平衡状态的依据是正逆反应速率相同,各组分含量不变,C(s)+2NO(g)N2(g)+CO2(g);
A.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g),说明反应逆向进行,不能说明反应达到平衡状态,故A错误;
B.碳是固体。当平衡发生移动,气体质量会发生变化,容器体积不变,所以混合气体的密度不再发生改变可以说明反应达到平衡状态,故B正确;
C.反应前后气体总物质的量不变,反应体系的压强始终不发生改变,不能判定平衡,故C错误;
D.C为固体,混合气体的平均相对分子质量保持不变,可知气体的质量不变,为平衡状态,故D正确;
故答案为BD;
(3)①已知0.5molCO2和1.5molH2转化率达80%时放热23-3.4=19.6kJ,则该反应的热化学方程式:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=-![]() ×2=-49kJmol-1,则热化学方程式为CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=-49kJ/mol;
×2=-49kJmol-1,则热化学方程式为CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=-49kJ/mol;
②由图象知:反应Ⅰ在较低温度T3时CO2就达到80%的转化率,催化剂效果最佳的反应是反应Ⅰ,T3的b点时,反应未达到限度,故v(正)>v(逆);该反应为放热反应,T4反应已经达到平衡,升高温度到T5平衡向逆反应移动,从而使CO2的转化率降低。T4的a点转化率比T5的c点高,c点时:
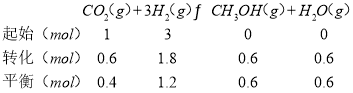
在恒容恒温条件下,气体的压强与气体的物质的量成正比,则平衡时总压强P总=100kPa×![]() =70kPa,该反应的平衡常数Kp=
=70kPa,该反应的平衡常数Kp=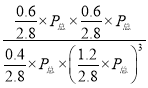 =8.3×10-4;
=8.3×10-4;
(4)当曲线Ⅰ变为曲线Ⅲ时一氧化碳物质的量浓度增大,反应是气体体积不变的反应,可变容器中气体体积和浓度成反比,气体物质的量不变,曲线Ⅰ,体积为3L,一氧化碳浓度为3mol/L,改变条件后为曲线Ⅱ,一氧化碳浓度为4.5mol/L,则体积压缩体积为:3:V=4.5:3,V=2L,所以将容器的体积快速压缩至2L满足条件。


科目:高中化学 来源: 题型:
【题目】叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成。
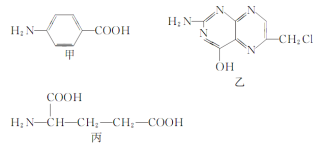
(1)甲中含氧官能团是__________(填名称)。
(2)下列关于乙的说法正确的是________(填序号)。
a.分子中碳原子与氮原子的个数比是7∶5 b.属于芳香族化合物
c.既能与盐酸又能与氢氧化钠溶液反应 d.属于苯酚的同系物
(3)丁是丙的同分异构体,且满足下列两个条件,丁的结构简式为________。
a.含有![]()
b.在稀硫酸中水解有乙酸生成
(4)写出丁在氢氧化钠溶液中水解的化学方程式。________
查看答案和解析>>
科目:高中化学 来源: 题型:
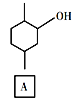
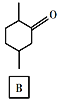
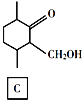
【题目】化合物E是一种药物合成中间体,其合成路线如下:
![]()
![]()
![]() D
D![]()
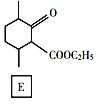
回答下列问题:
(1)A中的官能团名称是______。
(2)④的反应类型是______。
(3)B的分子式是______。
(4)D的结构简式是______。
(5)写出A到B的反应方程式______。
(6)H是A的同系物,含有六元碳环且比A少一个碳原子,则符合条件的H有______种(不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,对可逆反应:2X(g)+Y(g)![]() Z(g)+W(s) ΔH>0的下列叙述正确的是
Z(g)+W(s) ΔH>0的下列叙述正确的是
A.加入少量W,逆反应速度增大
B.升高温度时,正反应速率增大,逆反应速率减小
C.压强不变,充入与反应体系不反应的N2,反应速率减小;体积不变,充入N2,反应速度不变
D.平衡后加入X,上述反应的ΔH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
该小组用下图所示装置进行实验(夹持仪器略)
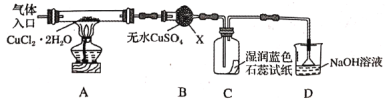
已知实验操作的步骤为:a.检查装置的气密性后加入药品→b.在“气体入口”处通入干燥HCl→c.点燃酒精灯,加热→d.反应一段时间,熄灭酒精灯,冷却→e.停止通入HCl,然后通入N2
(资料查阅)![]()
请回答下列问题:
(1)仪器X的名称是___________。
(2)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是___________。
(3)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质。根据资料信息
①若杂质是CuCl2,则产生的原因是_______________。
②若杂质是CuO,则产生的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将煤转化为水煤气的主要化学反应为C(s)+H2O(g)![]() CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:______________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出如图循环图,并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
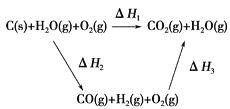
请甲、乙两同学观点正确的是________(填“甲”或“乙”);判断的理由是________________________________________________________。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是:
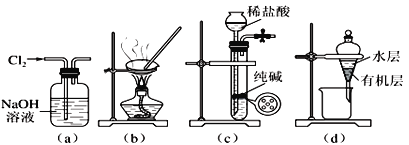
A. 用图(a)所示装置除去氯气中含有的少量氯化氢
B. 用图(b)所示装置蒸发氯化钠溶液制备氯化钠晶体
C. 用图(c)所示装置制取少量纯净的二氧化碳气体
D. 用图(d)所示装置分离苯萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁防护方法有多种,如图中的方法描述正确的是
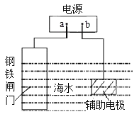
A.b为电源负极
B.该方法是牺牲阳极的阴极保护法
C.电子流向:a→钢铁闸门→辅助电极→b→a
D.电源改用导线连接进行防护时,辅助电极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下图所示装置,探究氯碱工业原理,下列说法正确的是
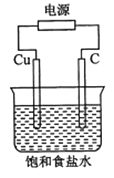
A.石墨电极与直流电源负极相连
B.用湿润KI淀粉试剂在铜电极附近检验气体,试纸变蓝色
C.氢氧化钠在石墨电极附近产生, Na+向石墨电极迁移
D.铜电极的反应式为:2H++ 2e-= H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com