
| A. | CH3COONa溶液中含有少量的CH3COOH | |
| B. | 醋酸钠溶液的pH大于7 | |
| C. | 醋酸钠溶液中滴入酚酞显红色,加热后颜色变深 | |
| D. | 醋酸钠溶液与浓H2SO4微热,可逸出醋酸蒸气 |
分析 A.醋酸钠溶液中含少量醋酸,说明醋酸钠是强碱弱酸盐,醋酸根离子水解;
B.醋酸钠溶液的pH>7,说明醋酸钠是强碱弱酸盐;
C.醋酸钠溶液中滴入酚酞试液显红色,说明醋酸钠是强碱弱酸盐,加热后颜色变深,升高温度促进水解;
D.醋酸钠和硫酸反应生成醋酸,浓硫酸稀释放出的热量使醋酸挥发.
解答 解:A.醋酸钠溶液中含少量醋酸,说明醋酸钠是强碱弱酸盐,醋酸根离子水解导致产生醋酸,不能说明盐类水解是吸热反应,故A错误;
B.醋酸钠溶液的pH>7,说明醋酸钠是强碱弱酸盐,不能说明盐类水解与反应热有关,故B错误;
C.醋酸钠溶液中滴入酚酞试液显红色,说明醋酸钠是强碱弱酸盐,加热后颜色变深,升高温度促进水解,则盐类水解是吸热反应,故C正确;
D.醋酸钠和硫酸反应生成醋酸,浓硫酸稀释放出的热量使醋酸挥发,不能说明盐类水解是吸热反应,故D错误;
故选C.
点评 本题考查化学实验方案评价,为偏高考点,明确实验原理是解本题关键,要证明盐类水解是吸热反应,只能通过温度改变引起反应方向改变来确定,易错选项是D.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:解答题
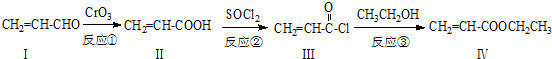
 也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为
也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的BaCl2溶液中:K+、Na+、OH-、NO3- | |
| B. | 使甲基橙变红的溶液中:Ca2+、NH4+、CH3COO-、Cl- | |
| C. | 无色透明的溶液中:Fe2+、SO42-、NO3-、Na+ | |
| D. | 由水电离出的c(H+)=10-12 mol•L-1的溶液中:Mg2+、K+、Br-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [H+]很小的溶液一定呈碱性 | |
| B. | pH=7的溶液一定呈中性 | |
| C. | [OH-]=[H+]的溶液一定呈中性 | |
| D. | 不能使酚酞试液变红的溶液一定呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用钥匙取用少量二氧化锰粉末 | |
| B. | 向燃着的酒精灯中直接添加酒精 | |
| C. | 实验室加热高猛酸钾制氧气的装置制取氨气 | |
| D. | 实验室将少量金属钠保存在煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用图所示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4.
实验室用图所示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L氧气含有的原子数目为NA | |
| B. | 锌从盐酸中置换出1 mol H2,转移的电子数目为NA | |
| C. | 4.4 g 二氧化碳含有的分子数目为0.1 NA | |
| D. | 1 mol/L CaCl2溶液中含有的氯离子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 离子半径的大小顺序:e>f>g>h | |
| B. | 与x形成简单化合物的沸点:y>z>d | |
| C. | x、z、d三种元素形成的化合物可能含有离子键 | |
| D. | e、f、g、h四种元素对应最高价氧化物的水化物相互之间均能发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com