
已知SO2和CO2都是酸性氧化物,其化学性质具有一定的相似性;镁和钠的化学性质也有一定的相似性。氧化铜和氧化铁都是碱性氧化物,其化学性质也有一定的相似性。三个研究性学习小组分别根据不同的课题进行研究,其方案如下:

Ⅰ.第一个研究性学习小组用如图Ⅰ所示的装置进行镁粉与二氧化硫反应的实验。
(1)实验室制取二氧化硫类似于制取 二氧化碳,在下列物质中选择合适的试剂制取二氧化硫:________。
二氧化碳,在下列物质中选择合适的试剂制取二氧化硫:________。
A.10%的硫酸 B.80%的硫酸
C.浓盐酸 D.稀硝酸
E.亚硫酸钠固体 F.亚硫酸钙固体 G.饱和亚硫酸钠溶液
(2)反应后,发现B管壁中有固体粉末产生,取反应后B管中的固体粉末溶于稀盐酸中,产生具有臭鸡蛋气味的气体,写出B管中发生反应的化学方程式:__________________________________________________。
(3)你认为该装置是否有不足之处?________。如果有,请写出改进方法: ________________________________________________________________。(如果无,此空不答)
Ⅱ.第二个研究性学习小组利用图Ⅱ所示装置来探究氨气的还原性。
(4)分别注明所用试剂:甲:________,乙:________,丙:氧化铜,丁:________。确定反应已发生的实验现象:_____________________________________________________________________________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.凡是放热反应都是自发的,因为吸热反应都是非自发的
B.自发反应的熵一定增大,非自发反应的熵一定减小
C.常温下,反应C(s)+CO2(g)  2CO(g)不能自发进行,则该反应的ΔH>0
2CO(g)不能自发进行,则该反应的ΔH>0
D.反应2Mg(s)+CO2(g)===C(s)+2MgO(s)能自发进行,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。
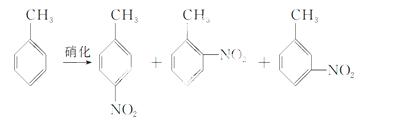
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶剂中,加入乙酸酐(有脱水作用),45 ℃反应1 h。反应结束后,过滤,滤液分别用5% NaHCO3溶液、水洗至中性,再经 分离提纯得到对硝基甲苯。
分离提纯得到对硝基甲苯。
(1)上述实验中过滤的目的是_________。
(2)滤液在分液漏斗中洗涤静置后,有机层处于 层(填“上”或“下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有_________。
(3)下表给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
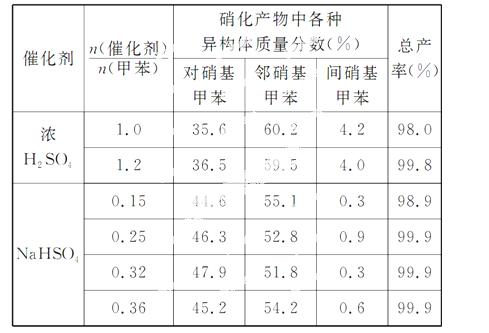
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为 。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是__________。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下述实验能达到预期目的的是( )
| 编号 | 实验内容 | 实验目的 |
| A | 将SO2通入酸性KMnO4溶液中 | 证明SO2的水溶液具有弱酸性 |
| B | 向少量火柴头的浸泡液中滴加AgNO3、稀HNO3和NaNO2 | 验证火柴头含有氯元素 |
| C | 在淀粉-KI溶液中滴加少量市售食盐配制的溶液 | 真假碘盐的鉴别 |
| D | 在少量Fe(NO3)2试样加水溶解的溶液中,滴加稀H2SO4酸化,再滴加KSCN溶液 | 检验Fe(NO3)2试样是否变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
油条是一种深受群众喜爱的传统食品,在百姓早餐桌上一直占有重要位置。但油条中铝含量超标问题十分普遍,是影响群众健康的食品安全隐患。从2009年5月下旬开始,浙江省的油条加工停用含铝的食品添加剂,逐步转换为无铝的食品添加剂配方和工艺,从而保证百姓吃上安全、放心的油条。油条无铝配方由碳酸氢钠(小苏打)和碳酸氢铵(臭粉)组成。为测定试样中小苏打的质量分数ω(NaHCO3),实验小组同学设计了如下装置进行实验。

实验过程:
①按上图组装仪器,检查装置的气密性;
②将试样m1 g放入硬质玻璃管中,装置B、C、D中药品如上 图,已知加药品后装置B的质量为m2 g、装置C的质量为m3 g;
图,已知加药品后装置B的质量为m2 g、装置C的质量为m3 g;
③关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;
④称得装置B的质量为m4 g、装置C的质量为m5 g。
请回答以下问题(装置中原有空气对实验的影响忽略不计):
(1)装置A中发生反应的化学方程式为
________________________________________________________________________
________________________________________________________________________。
(2)装置B的作用为
________________________________________________________________________;
装置C的作用为
________________________________________________________________________。
(3)实验过程中通入N2的目的为
________________________________________________________________________。
(4)用下列各项所提供的数据能计算出ω(NaHCO3)的是________(填选项字母)。
| 序号 | a | b | c | d | e |
| 数据 | m1、m2、m3 | m2、m3、m4、m5 | m1、m2、m4 | m1、m4、m5 | m1、m3、m5 |
(5)实验结束后发现装置A中硬质玻璃管右端有水珠,你认为利用实验中所提供的数据还能否得到准确的ω(NaHCO3),若能,写出ω(NaHCO3)的计算式。
________(填“能”或“不能”),________(若不能,此空不作答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
目前“低碳减排”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。
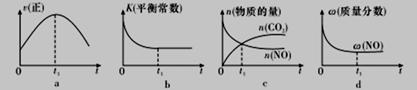
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂表面积(S)和时间(I)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂表面积(S)和时间(I)的变化曲线如图所示。

据此判断:
①该反应的△H_____________0(填“>”或“<”)。
②在T2温度下,0-2s内的平均反应速率v(N2) =____________mol/(L·s)。
③当固体催化剂的质量一定时,增大其表面积可增大化学反应速率。若催化剂的表面积S1>S2,在答题卡相应图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_______________(填代号)。
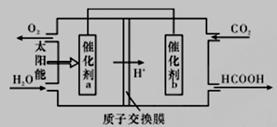
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol
2NO2(g)=N2O4(g) △H=-867kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式:_____________________。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用,以CO2(g)和H2O(g)为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应为_________________。
③常温下0. 1 mol/L的HCOONa溶液pH为10,则HCOOH的电离常数Ka =_______________mol·L-1(填写最终计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
X2(g) + 3Y2(g) 2XY3(g) △H=-92.6 kJ.mol-1
2XY3(g) △H=-92.6 kJ.mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | |||
| ① | 1 | 3 | 0 | 2分钟 | 放热46.3kJ |
| ② | 0.4 | 1.2 | 1.2 | / | Q(Q>0) |
下列叙述不正确的是
A. 容器①中反应从开始到刚达平衡时用XY3表示的反应速率为v(XY3)=1/30 moI.L-l·s-1
B. 平衡时,两个容器中XY3的物质的量浓度相等
C. 器②中反应达到平衡时吸收的热量为Q
D. 容器①体积为0.3L,则达平衡时放出的热量大于46.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值,下列有关NA 的叙述中正确的有
①标准状况下,20 g重水(D2O)中含有的电子数为10NA
②0.5 molFe2-被足量的H2O2溶液氧化,转移0.5 NA个电子
③将2 mol NO和1 mol O2混合后,体系中的分子总数为3NA
④乙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
⑤2 mol·L-1碳酸钠溶液中Na+的数目是2NA
⑥1 mol氯气溶解在水中得到的新制氯水中氢离子的数目是NA
⑦22.4 L的N2的共用电子对数为3NA
A、3个 B、4个 C、5个 D、全部正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com