
I.常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
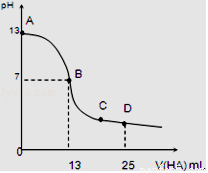
(1)写出MOH的电离方程式:__________________
(2)MOH与HA恰好完全反应时,溶液呈________性(填“酸”、“碱”或“中”),理由是(用离子方程式表示):________________________________________________。
(3)D点时,溶液中c(A﹣)+c(HA)__________2c(M+)(填“>”、“<”或“=”).
II.室温下,几种物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.3×10-12 |
(1)室温下,某酸性CuCl2溶液中含少量的FeCl3,为得纯净CuCl2溶液,宜加入__________调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=__________________
(2)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(杂质不与I―发生氧化还原反应)的纯度,过程如下:取试样溶于水,加入过量KI固体,充分反应,有白色沉淀(CuI)产生。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液V mL。(已知:I2+2S2O32- S4O62-+2I―。)
S4O62-+2I―。)
①CuCl2溶液与KI反应的离子方程式为______________________________。
②可选用________作滴定指示剂,滴定终点的现象是:滴入最后一滴Na2S2O3,________________。
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源:2015-2016学年浙江省高二上期中测试化学试卷(解析版) 题型:选择题
下列实验能达到预期目的的是( )
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸;②用NaOH溶液除去苯中的少量苯酚;③用饱和NaHCO3溶液除去CO2中的少量SO2;④用加热的方法提取NH4Cl固体中混有的少量碘;⑤用酒精萃取碘水中的碘。
A.①⑤ B.①②④⑤ C.②③ D.②③⑤
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期12月质检化学试卷(解析版) 题型:选择题
分别依据下列实验事实,得出的结论正确的是
实验事实 | 结论 | |
A | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 | 随溶液pH减小,“84”消毒液的氧化能力增强 |
B | 苯酚和水的浊液中,加碳酸钠溶液,溶液变澄清 | 苯酚的酸性比碳酸强 |
C | 铜放入稀硫酸中,无明显现象,再加入硝酸钠固体,溶液变蓝,有明显的气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
D | 向1mL 0.1mol/L的硝酸银溶液中加入1mL0.1mol/LNaCl溶液,出现白色沉淀,再加入几滴0.1mol/L NaBr溶液,有淡黄色沉淀生成 | 氯化银的溶解度小于溴化银 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东汕头金山中学高二上10月月考化学卷(解析版) 题型:选择题
一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(s).2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L.下列判断正确的是( )
A.该条件下此反应的化学平衡常数约为0.91
B.A的平均反应速率为0.3mol/(L•s)
C.B的转化率为60%
D.若混合气体的密度不再改变时,该反应不一定达到平衡状态
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东汕头金山中学高一上12月月考化学卷(解析版) 题型:选择题
设nA为阿伏加德罗常数的数值,下列说法正确的是
A.常温常压下,8 g O2含有4nA个电子
B.标准状况下22.4 L的NH3溶于水,所得溶液中有nA个NH4+
C.200 mL的5 mol·L-1盐酸中含有nA个HCl分子
D.1mol Na被完全氧化生成Na2O2,失去2nA个电子
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上二调考试化学试卷(解析版) 题型:选择题
下列有关说法正确的是( )
A.CH3COOH溶液加水稀释后,溶液中c(CH3COOH)/c(CH3COO-) 的值增大
B.保护钢铁设备时,以钢铁设备作负极,纯铜作正极
C.反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0
D.Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,溶液的pH 减小
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上期中(理)化学试卷(解析版) 题型:选择题
在室温下等体积的酸和碱的混合溶液,混合后pH值一定小于7的是
A.pH=3的硝酸跟pH=11的氢氧化钾溶液
B.pH=3的盐酸跟pH=11的氨水
C.pH=3的醋酸跟pH=11的氢氧化钡溶液
D.pH=3的硫酸跟pH=11的氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是

A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)= c(A—)+ c(HA)
D.b点所示溶液中c(A—)> c(HA)
查看答案和解析>>
科目:高中化学 来源:2016届江西师大附中,九江一中高三上期中化学试卷(解析版) 题型:实验题
草酸钴用途广泛,可用于指示剂和催化剂的制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将_____________还原(填离子符号)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价。该反应的离子方程式为____________。
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是_________;使用萃取剂适宜的pH是______。

A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c (Ca2+)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com