
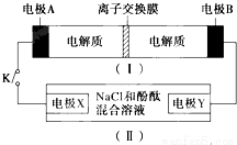
| A. | 闭合K时,X的电极反应式为:2H++2e-═H2↑ | |
| B. | 闭合K时,A电极反应式为:NiO2+2e-+2H+═Ni(OH)2 | |
| C. | 给装置(Ⅰ)充电时,B极参与反应的物质被氧化 | |
| D. | 给装置(Ⅰ)充电时,OH-通过阴离子交换膜,移向A电极 |
分析 当闭合开关K时,II是电解池,电极Y附近溶液先变红,说明Y电极附近有氢氧根离子生成,则为阴极,X为阳极,所以A是正极、B是负极,
A.闭合开关K后,电极X是阳极,阳极上氯离子失电子生成氯气;
B.闭合开关K后,A电极是正极得电子发生还原反应;
C.电池充电时,原来负极应该连接电源负极作阴极;
D.电池充电时,OH-通过阴离子交换膜,移向阳极.
解答 解:当闭合开关K时,II是电解池,电极Y附近溶液先变红,说明Y电极附近有氢氧根离子生成,则为阴极,X为阳极,所以A是正极、B是负极,
A.闭合开关K后,电极X是阳极,阳极上氯离子失电子生成氯气,电极反应为:2Cl--2e-═Cl2↑,故A错误;
B.闭合开关K后,A电极是正极得电子发生还原反应,反应为NiO2+2e-+2H2O═Ni(OH)2+2OH-,故B错误;
C.电池充电时,原来负极B应该连接电源负极作阴极,被还原,故C错误;
D.电池充电时,原来正极A应该连接电源正极作阳极,所以OH-通过阴离子交换膜,移向A电极阳极,故D正确;
故选D.
点评 本题考查化学电源新型电池,明确原电池原理即可解答,难点是电极及电池反应式的书写,要结合电解质溶液书写,为学习难点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:| 溶质的物质的量浓度/mol•L-1 | 溶液的密度/g•cm-3 | |
| 硫酸 | c1 | ρ1 |
| 氨水 | c2 | ρ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率用HI表示时,v(HI)=0.008 mol•L-1•min-1 | |
| B. | 两个化学方程式的意义相同,但其平衡常数表达式不同,不过计算所得数值相同 | |
| C. | 氢气在两个反应方程式中的转化率不同 | |
| D. | 第二个反应中,增大压强平衡向生成HI的方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热的化学反应都是吸热反应 | |
| B. | 陶瓷、玻璃和水泥都是无机非金属材料 | |
| C. | 醋酸、蔗糖均属于电解质 | |
| D. | 糖类、油脂和蛋白质都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 三氯异氰尿酸是一种极强的氧化剂和氯化剂,利用氰尿酸(如图1)与次氯酸在一定pH下反应可制备三氯异氰尿酸(如图2),若原料完全反应生成三氯异氰尿酸.则氰尿酸和次氯酸的物质的量之比应为( )
三氯异氰尿酸是一种极强的氧化剂和氯化剂,利用氰尿酸(如图1)与次氯酸在一定pH下反应可制备三氯异氰尿酸(如图2),若原料完全反应生成三氯异氰尿酸.则氰尿酸和次氯酸的物质的量之比应为( )| A. | 1:1 | B. | 2:3 | C. | 1:2 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在乳酸菌作用下迅速分解为无毒物质.下列有关降解塑料叙述错误的是( )
在乳酸菌作用下迅速分解为无毒物质.下列有关降解塑料叙述错误的是( )| A. | 降解塑料是一种高分子化合物 | B. | 其分子量为72n | ||
| C. | 经加聚反应生成 | D. | 其单体是CH3CH(OH)COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氢氧化钡溶液于稀硫酸反应:Ba2++H++OH-+SO42-═BaSO4↓+H2O | |
| B. | 往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O | |
| C. | 常温下氯气与烧碱溶液反应:Cl2+2OH -═Cl-+ClO-+H2O | |
| D. | 实验室中氯气的制取:MnO2+4H++2Cl-$\frac{\underline{\;△\;}}{\;}$Mn2++Cl2↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com