
【题目】下列措施或事实不能用勒夏特列原理解释的是
A. H2、I2(g)、HI平衡混合气体加压后颜色变深(已知:H2 +I2(g)![]() 2HI)
2HI)
B. 合成氨时,将混合气体中的NH3液化有利于提高产率
C. 实验室用排饱和食盐水的方法收集氯气
D. 滴加酚酞的氨水中加入氯化铵固体后红色变浅
【答案】A
【解析】A、根据反应方程式,反应前后气体系数之和相等,增大压强,平衡不移动,加压后颜色变深,是因为气体浓度增大,与勒夏特列原理无关,故A正确;B、N2(g)+3H2(g) ![]() 3NH3(g) ,将NH3液化,相当于减少生成物的浓度,平衡向正反应方向移动,有利于提高产率,与勒夏特列原理有关,故B错误;C、Cl2与H2O反应:Cl2+H2O
3NH3(g) ,将NH3液化,相当于减少生成物的浓度,平衡向正反应方向移动,有利于提高产率,与勒夏特列原理有关,故B错误;C、Cl2与H2O反应:Cl2+H2O![]() H++Cl-+HClO,加入饱和食盐水,增加c(Cl-)浓度,平衡向逆反应方向移动,抑制Cl2与水的反应,与勒夏特列原理有关,故C错误;D、NH3·H2O的电离:NH3·H2O
H++Cl-+HClO,加入饱和食盐水,增加c(Cl-)浓度,平衡向逆反应方向移动,抑制Cl2与水的反应,与勒夏特列原理有关,故C错误;D、NH3·H2O的电离:NH3·H2O![]() NH4++OH-,氨水中加入氯化铵,c(NH4+)增大,平衡向逆反应方向移动,c(OH-)减少,溶液颜色变浅,与勒夏特列原理有关,故D错误。
NH4++OH-,氨水中加入氯化铵,c(NH4+)增大,平衡向逆反应方向移动,c(OH-)减少,溶液颜色变浅,与勒夏特列原理有关,故D错误。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
【题目】将二氧化硫通入到氯化钡溶液中未见到明显现象,把上述溶液分为两份,其中一份a加入NaOH溶液,另一份b中通入Cl2 , 均有白色沉淀产生,其中a中沉淀的化学式为 , b中沉淀的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A、B两个装置中的烧杯分别盛有足量的CuCl2溶液。

(1)A、B、C三个装置中属于原电池的是________(填标号,下同),属于电解池的是_____________
(2)A池中Zn是_____极,电极反应式为________;Cu是______极,电极反应式为______________,A中总反应的方程式为________________________。
(3)B池中总反应的方程式为________________。
(4)C池中Zn是____极,电极反应式为_____;Cu是______极,电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组需配制含有NH![]() 、Cl-、K+、SO42-的植物培养液500 mL,且要求该培养液中c(Cl-)=c(K+)=c(SO42—)=0.4 mol·L-1。实验室提供的药品有:NH4Cl、KCl、(NH4)2SO4、K2SO4和蒸馏水;提供的实验仪器有:①药匙 ②托盘天平 ③烧杯 ④胶头滴管 ⑤量筒。请回答下列问题:
、Cl-、K+、SO42-的植物培养液500 mL,且要求该培养液中c(Cl-)=c(K+)=c(SO42—)=0.4 mol·L-1。实验室提供的药品有:NH4Cl、KCl、(NH4)2SO4、K2SO4和蒸馏水;提供的实验仪器有:①药匙 ②托盘天平 ③烧杯 ④胶头滴管 ⑤量筒。请回答下列问题:
(1)该植物培养液中,NH![]() 的物质的量浓度为__________mol·L-1;
的物质的量浓度为__________mol·L-1;
(2)该研究小组配制该植物培养液时,还须用到的玻璃实验仪器有__________、__________;
(3)甲同学用NH4Cl、(NH4)2SO4和K2SO4三种物质进行配制,则需硫酸铵的质量为__________g;
(4)若配制该培养液的其他操作均正确,则下列错误操作将使所配制溶液的浓度偏低的是__________。
a.将溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
b.将烧杯内的溶液向容量瓶中转移时,容量瓶中还有少量的水
c.将烧杯内的溶液向容量瓶中转移时,因操作不当使部分溶液溅出容量瓶
d.用胶头滴管向容量瓶中加水时,俯视容量瓶刻度线
e.摇匀后发现液面低于容量瓶刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中能证明一种气体为SO2的是( )
①使澄清石灰水变浑浊 ②使湿润的蓝色石蕊试纸变红 ③使品红溶液褪色 ④通入足量的NaOH溶液中,再滴加BaCl2溶液,有白色沉淀生成,该沉淀溶于稀盐酸 ⑤通入溴水中使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀产生
A.都能证明
B.都不能证明
C.③④⑤能证明
D.只有⑤能证明
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是

A. 该电池不适宜在过高或过低温度下使用
B. 正极反应中有CO2生成
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2==6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浅绿色晶体X[x(NH4)2SO4·yFeSO4·zH2O]在分析化学中常用作还原剂. 为确定其组成,某小组同学进行如下实验.
I.NH4+的测定
采用蒸馏法,蒸馏装置如图所示。
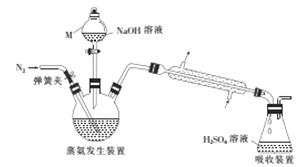
相关的实验步骤如下:
①准确称取58.80g晶体X,加水溶解后,将溶液注入三颈烧瓶中;
②准确量取50.00mL3.0300molL-1H2SO4溶液于锥形瓶中;
③向三颈烧瓶中加入足量NaOH溶液,通入氮气,加热,蒸氨结束后取下锥形瓶;
④用0.120molL-1NaOH标准溶液滴定锥形瓶中过量的硫酸,滴定终点时消耗25.00mL NaOH标准溶液.
(1)仪器M的名称为__________。
(2)步骤③中,发生的氧化还原反应的化学方程式为____________。蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行“处理”,“处理”的操作方法是_____________。
(3)步骤④中,若振荡时锥形瓶中有液体溅出,则所测得的n(NH4+)的值将______(填“偏大”“偏小”或“不变”)。
II.SO42-含量的测定
采用重量分析法,实验步骤如下:
①另准确称取58.80g晶体X 于烧杯中,加水溶解,边搅拌边加入过量的BaCl2溶液;
②将得到的溶液用无灰滤纸(灰分质量很小,可忽略)过滤,洗涤沉淀3~4次;
③用滤纸包裹好沉淀取出,灼烧滤纸包至滤纸完全灰化;
④继续灼烧沉淀至恒重、称量,得沉淀质量为69.90g。
(4)步骤①中,判断BeCl 溶液已过量的实验操作和现象是___________。
(5)步骤②中,采用冷水洗讓沉淀,其主要目的是___________。
(6)结合实验Ⅰ、Ⅱ通过计算得出晶体X的化学式为__________。实验I 的步骤①中,溶液中离子溶度由大到小的顺序为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯推测丙烯(CH3CH=CH2)与溴水反应时,对反应产物的推测正确的是
A.CH2BrCH2CH2BrB.CH3CHBr2CH3
C.CH3CH2CHBrD.CH3CHBrCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,在指定条件下能大量共存的离子组是
A. 无色透明溶液中:Na+ 、Cu2+ 、Cl- 、S2
B. 遇酚酞试剂变红的溶液:Fe3+ 、K+ 、SO42 、NO![]()
C. 含有大量 CO32-的溶液:K+ 、 Ba2+ 、OH- 、SO42
D. 含有大量 H+ 的溶液:Mg2+ 、NH4+ 、NO3- 、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com