
| A. | KF | B. | AlCl3 | C. | NaI | D. | MgBr2 |
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 5.8g正丁烷与异丁烷组成的混合气体中含有的C-H键数目为NA | |
| B. | 1mol的CO2和水蒸气的混合气体与过量Na2O2充分反应转移的电子数为2NA | |
| C. | 将0.2molNH3充入密闭容器中在一定条件下加热分解,生成N2的分子数为0.1NA | |
| D. | 相同温度下50mL0.1mol•L-1CH3COOH溶液和10mL0.5mol•L-1CH3COOH溶液中所含CH3COOH分子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z、W、Q、X、Y原子半径依次减小 | |
| B. | W最高价氧化物对应水化物一定能溶于Z最高价氧化物对应水化物的溶液中 | |
| C. | Y与Q形成化合物在常温下一定为气态 | |
| D. | Z、Q元素的单质都可以将X元素的单质从其氧化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
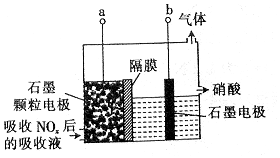
| A. | 吸收NOx的过程涉及氧化还原反应 | |
| B. | 石墨电极为颗粒状,可增大接触面积,提高电解效率 | |
| C. | 当b极上产生2.8 L(标准状况)H2时,转移的电子数为0.5NA(设NA为阿伏加德罗常数的数值) | |
| D. | a极的电极反应式为HNO2-2e-+H2O═3H++NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12gC与16gO2所具有的总能量一定高于28gCO所具有的能量 | |
| B. | 56gCO所具有的能量大于88gCO2所具有的能量 | |
| C. | 12gC和32gO2所具有的总能量大于44gCO2所具有的能量 | |
| D. | 将一定质量的碳燃烧,生成CO2比生成CO时放出的热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电子从b流出,经外电路流向a | |
| B. | HS在硫氧化菌作用下转化为SO42-的反应是HS-+4H2O-8e-═SO42-+9H+ | |
| C. | 如果将反应物直接燃烧,能量的利用率不会变化 | |
| D. | 若该电池电路中有0.4mol电子发生转移,则有0.5mol H+通过质子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向甲、乙、丙三个恒容密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).相关数据如表,反应过程中C的浓度随时间变化关系如图.下列说法正确的是( )
向甲、乙、丙三个恒容密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).相关数据如表,反应过程中C的浓度随时间变化关系如图.下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6 mol A 2 mol B |
| A. | T1>T2,x=1 | |
| B. | T2℃时,该反应的平衡常数为0.8 | |
| C. | A的平衡转化率a(甲):a(乙)=2:3 | |
| D. | 15~20min内C的平均反应速率v(乙)<v(丙) |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高二上第一次月考化学试卷(解析版) 题型:实验题
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
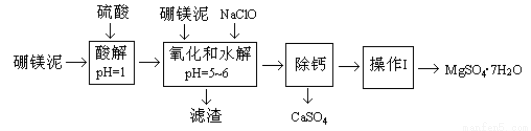
根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有 。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有 。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式 。
在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为 。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法 。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤 、 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省新乡市高二上第一次月考化学卷(解析版) 题型:填空题
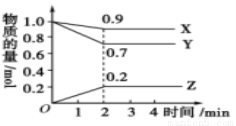
某温度时,在容积为2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式为____________________;反应开始至2 min时,Z的平均反应速率为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com