
| A. | 用CCl4萃取碘水中的I2 | B. | 粗盐(混有泥沙、MgSO4•FeCl3)的提纯 | ||
| C. | 用蒸馏方法分离CCl4和I2的混合物 | D. | 用浓HCl配制一定量浓度的稀HCl |
分析 A.萃取主要仪器为分液漏斗和烧杯;
B.粗盐提纯用过滤的方法;
C.蒸馏用到蒸馏烧瓶、酒精灯、温度计、冷凝管、锥形瓶以及牛角管等;
D.用浓HCl配制一定量浓度的稀HCl,用到烧杯、量筒、胶头滴管以及容量瓶等.
解答 解:A.用CCl4萃取碘水中的I2用萃取的方法,主要仪器为分液漏斗和烧杯;
B.粗盐提纯用过滤的方法,用到的玻璃仪器有烧杯、漏斗、玻璃棒等;
C.蒸馏用到蒸馏烧瓶、酒精灯、温度计、冷凝管、锥形瓶以及牛角管等;
D.用浓HCl配制一定量浓度的稀HCl,用到烧杯、量筒、胶头滴管以及容量瓶等,
可知用玻璃仪器最少的为萃取.
故选A.
点评 本题为实验题,考查了蒸馏实验、萃取、分液用到的仪器及操作和注意事项,明确实验原理是解题关键,注意蒸馏实验中温度计位置、冷凝水流向,题目难度不大.


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:解答题
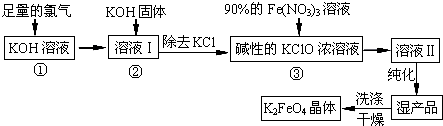
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精--易燃品 | B. | 浓硫酸--腐蚀品 | ||
| C. | 烧碱--剧毒品 | D. | 氯酸钾--强氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
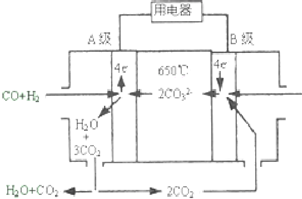 熔融碳酸盐燃料电池(MCFS),发明于1889年.现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示.请回答下列问题:
熔融碳酸盐燃料电池(MCFS),发明于1889年.现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 甲是原电池,乙是电镀装置 | |
| B. | 甲、乙装置中,锌极上均发生氧化反应 | |
| C. | 乙、丙装置中,阳极均发生氧化反应而溶解 | |
| D. | 乙、丙装置中,c(Cu2+)基本不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、H+、Cl-、CO32- | B. | K+、Cu2+、SO42-、NO${\;}_{3}^{-}$ | ||
| C. | H+、Na+、OH-、Cl- | D. | Mg2+、Al3+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com