
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:

(1)MgCO3与稀硫酸反应的离子方程式为 。
(2)加入H2O2氧化时,发生反应的化学方程式为 。
(3)滤渣2的成分是 (填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C ![]() 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C![]() MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分布吸收或收集。
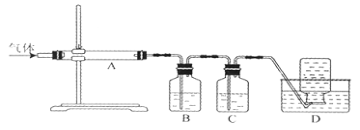
①D中收集的气体是 (填化学式)。
②B中盛放的溶液可以是 (填字母)。
a.NaOH溶液 B.Na2CO3溶液 C.稀硝酸 D.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: 。
【答案】(1)MgCO3+2H+=Mg2++CO2↑+H2O(2分)
(2)2FeSO4 +H2O2+H2SO4 =Fe2(SO4)3 +2H2O(2分)
(3)Fe(OH)3 (2分)
(4)①CO(2分)②d(2分)③3S+6OH-![]() 2S2-+SO32-+3H2O(2分)
2S2-+SO32-+3H2O(2分)
【解析】
试题分析:菱镁矿的主要成分为MgCO3,含少量FeCO3,根据上述流程图,向菱镁矿中加入稀硫酸,FeCO3、MgCO3均会反应,生成FeSO4 和MgSO4 ,过滤除去不与硫酸反应的杂质,再加入H2O2 ,目的是将FeSO4 氧化成Fe2(SO4)3 ,加入氨水调节pH=4将Fe3+ 变成Fe(OH)3 沉淀,得到滤渣2从而除去,之后将MgSO4 溶液蒸干得到MgSO4 固体,再用木炭还原法制备高纯氧化镁,据此回答。
(1)MgCO3是难溶电解质,书写离子方程式时不能拆开,所以MgCO3与稀硫酸反应的离子方程式为MgCO3+2H+=Mg2++CO2↑+H2O。
(2)根据上述分析,加入H2O2的目的是将FeSO4 氧化成Fe2(SO4)3,反应的化学方程式为2FeSO4 +H2O2+H2SO4 =Fe2(SO4)3 +2H2O。
(3)加氨水调节溶液的PH的目的是使铁元素沉淀而镁不能沉淀,铁元素在溶液中以铁离子形式存在,所以滤渣2的成分是Fe(OH)3。
(4)①右图装置对煅烧产生的气体进行分步吸收或收集,所以最终的剩余气体为CO,即D中收集的气体是CO。
②反应产生的气体产物有SO2、CO2、CO,三种气体分步被吸收或收集,SO2、CO2都能与a、b反应,与c都不能反应,而高锰酸钾溶液可与SO2反应,所以B中应放高锰酸钾溶液吸收SO2,答案选d。
③淡黄色固体为S,与热的NaOH溶液发生歧化反应,S被氧化为SO32-,同时被还原成S2-,其离子方程式为3S+6OH-![]() 2S2-+SO32-+3H2O。
2S2-+SO32-+3H2O。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且有些可以再生。下列属最有希望的新能源的是( )
①天然气②煤③核能④水力发电⑤太阳能⑥燃料电池⑦风能⑧氢能
A. ①②③④ B. ③⑤⑥⑦⑧ C. ③④⑤⑥ D. 除①②外
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了部分元素在周期表中的位置,请用具体的元素完成下列填空。
族 周期 | ⅠA | 0 | ||||||||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||||||||
2 | X | Y | G | |||||||||||
3 | Z | …… | H | W | E | Q | ||||||||
(1)上述元素的原子中,得电子能力最强的是______________(填元素名称)。
2)化学性质最不活泼的是___________(填元素符号)。
(3)G对应离子的半径______________Z对应离子的半径(填“<”或“>”)。
(4)写出H与Z的最高价氧化物的水化物溶液反应的离子方程式:________________。
(5)元素X的最高价氧化物的电子式________________,元素W的最高价氧化物为
_______________(填晶体类型)。
(6)为比较元素X和W的非金属性强弱,用下图所示装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B的作用是________________,能说明X和W非金属性强弱的化学方程式是_________________________________。
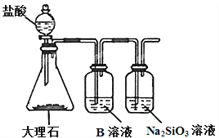
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是:
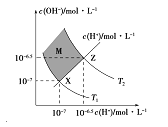
A. 两条曲线间任意点均有c(H+)×c(OH-)=KW
B. M区域内任意点均有c(H+)<c(OH-)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素是______。(用元素符号表示)
(2)②③④三种元素的原子半径从大到小的顺序是______(用元素符号表示)
(3)用电子式表示③与⑦形成化合物的过程_______________________。
(4)在①~⑧元素中,元素的最高价氧化物对应的水化物中碱性最强的___。(填化学式)
(5)在⑦与⑩的单质中,化学性质较活泼的是_____。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【江西省师大附中、临川一中2017届高三1月联考理综】等体积浓度均为0.1mol/L的三种溶液:①CH3COOH溶液、②HSCN溶液、③NaHCO3溶液混合,①、②分别与③混合,实验测得产生的CO2气体体积(V)随时间(t)的变化如图所示,下列说法正确的是( )

A. 三种溶液pH的比较③>②>①
B. 反应结束后所得两溶液中,c(CH3COO-)>c(SCN-)
C. 上述三种溶液中水电离的电离度:NaHCO3>CH3COOH>HSCN
D. ①与③反应所得的溶液中:c(CH3COO-) + c(CH3COOH) = 0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中存在的碘的稳定性核素是碘-127(![]() I)。日本福岛第一核电站事故释放出的放射性物质中,含有人工放射性核素碘-131(
I)。日本福岛第一核电站事故释放出的放射性物质中,含有人工放射性核素碘-131(![]() I)。碘-131(
I)。碘-131(![]() I) 一旦被人体吸入,就可能会引发甲状腺疾病。对于这两种核素的下列说法正确的是
I) 一旦被人体吸入,就可能会引发甲状腺疾病。对于这两种核素的下列说法正确的是
A. ![]() I是一种新元素 B.
I是一种新元素 B. ![]() I的摩尔质量为131g
I的摩尔质量为131g
C. ![]() I和
I和![]() I互为同位素 D.
I互为同位素 D. ![]() I中子数与质子数之差为74
I中子数与质子数之差为74
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据水溶液中离子平衡的知识回答下列问题:
I.已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,则
(1)该溶液中c (H+)=________,HA的电离平衡常数Ka=________;
(2)由HA电离出的c(H+)约为水电离出的c (H+)的________倍。
II.常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和NaNO3溶液中的一种。已知A、B的水溶液中水的电离程度相同,A、C溶液的pH相同,则:B是________,C是________。常温下若B溶液中c(OH-)与C溶液中c(H+)相同,B溶液的pH用pHb表示,C溶液的pH用pHc表示,则pHb+pHc=________(填某个数)。
III.将pH=1的稀硫酸慢慢加入一定量的BaCl2溶液中,恰好使Ba2+沉淀完全时溶液的体积为100 mL(混合时溶液体积变化忽略不计),溶液的pH=2,则原BaCl2 溶液中Cl-的浓度为 mol/L。(结果保留两.位.有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200 oC左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2 =2CO2 +3H2O, 电池示意如右图,下列说法不正确的是:
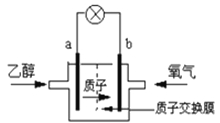
A.b极为电池的正极
B.电池正极的电极反应为:4H+ + O2 + 4e- =2H2O
C.电池工作时电子由b极沿导线经灯泡再到a极
D.电池工作时,1mol乙醇被氧化时就有12mol电子转移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com