
| A. | 水溶性:SO2>Cl2>CO2 | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 稳定性:NH3>H2O>HF | D. | 沸点:F2<Cl2<Br2<I2 |
分析 A.极性溶质易溶于极性溶剂,非极性溶质易溶于非极性溶剂;
B.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
C.非金属性越强,气态氢化物越稳定;
D.含有氢键,沸点反常的高,不含氢键的,相对分子质量越大,沸点越高.
解答 解:A.极性溶质易溶于极性溶剂,非极性溶质易溶于非极性溶剂,水溶性:SO2>Cl2>CO2,故A正确;
B.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,酸性:HClO4>H2SO4>H3PO4,故B正确;
C.非金属性越强,气态氢化物越稳定;稳定性:NH3<H2O<HF,故C错误;
D.含有氢键,沸点反常的高,不含氢键的,相对分子质量越大,沸点越高,沸点:F2<Cl2<Br2<I2,故D正确.
故选:C.
点评 本题考查非金属性、金属性的比较、最高价氧化物的水化物酸性强弱、氢化物稳定性、沸点比较,为高频考点,侧重于学生的分析能力的考查,注意把握元素在周期表中的变化规律,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
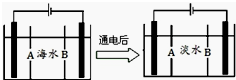 科研人员对某岛上山泉水进行分析化验,结果显示山泉水属于硬水.
科研人员对某岛上山泉水进行分析化验,结果显示山泉水属于硬水.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
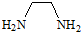 )在一定条件下发生反应生成1mol EDTA和4mol HCl,则EDTA的分子式为( )
)在一定条件下发生反应生成1mol EDTA和4mol HCl,则EDTA的分子式为( )| A. | C10H16N2O8 | B. | C10H20N2O8 | C. | C8H16N2O8 | D. | C16H20N2O8Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 已知条件 | 热化学方程式 | |
| A | CH4的燃烧热(△H)为-890kJ• mol-1 | CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H=-890kJ• mol-1 |
| B | 中和热△H=-57.3kJ•mol-1 | CH3COOH(aq)+NaOH(aq)═H2O+CH3COONa (aq)△H=-57.3kJ•mol-1 |
| C | 一定条件下,0.5mol N2与1.5mol H2充分反应后放出30.5kJ的热量 | N2(g)+3H2(g)?2NH3(g)△H=-61kJ•mol-1 |
| D | 96g O2的能量比96g O3的能量低bkJ | 3O2(g)?2O3(g)△H=+bkJ• mol-1 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_8^{18}$O表示中子数为8的氧原子 | B. | 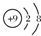 表示氟原子的结构示意图 表示氟原子的结构示意图 | ||
| C. | 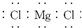 表示MgCl2的电子式 表示MgCl2的电子式 | D. | 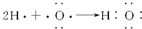 H表示H2O的形成过程 H表示H2O的形成过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com