
| A. | 生石灰溶于水;锌粒和稀硫酸反应 | |
| B. | 稀释浓硫酸;金属或金属氧化物熔化 | |
| C. | 氢氧化钠和盐酸反应;二氧化碳和碳反应 | |
| D. | 工业煅烧石灰石;化石燃料燃烧 |
分析 放热反应包括:大多数的化合反应;金属和酸或水的反应;酸碱中和反应;所有的燃烧反应;铝热反应;
放热反应包括:大多数的分解反应;以C、CO和氢气为还原剂的氧化还原反应;铵盐和碱的反应.据此分析.
解答 解:A、生石灰溶于水是化合反应,是放热反应;锌和稀硫酸的反应为放热反应,故A错误;
B、浓硫酸的稀释不是化学反应,金属或金属氧化物的融化也不是化学反应,故B错误;
C、氢氧化钠和盐酸的反应为酸碱中和,为放热反应;而二氧化碳和C的反应是以C为还原剂的氧化还原反应,故为吸热反应,故C正确;
D、工业煅烧石灰石是分解反应,故为吸热反应;化石燃料的燃烧为放热反应,故D错误.
故选C.
点评 本题考查了常见的吸放热反应,难度不大,应注意的是浓硫酸的稀释、物质的物理状态的改变均不是化学反应.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,用0.1000mol•L-1的盐酸滴定0.1000mol•L-1Na2CO3溶液25.00mL.用 pH传感器测得混合溶液的pH变化曲线如图,下列说法正确的是( )
常温下,用0.1000mol•L-1的盐酸滴定0.1000mol•L-1Na2CO3溶液25.00mL.用 pH传感器测得混合溶液的pH变化曲线如图,下列说法正确的是( )| A. | c→d发生的主要离子反应:HCO3-+H+=H2O+CO2 | |
| B. | 在b点 时,c(CO32-)>c(HCO3)->c(OH-) | |
| C. | 在d点 时,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | |
| D. | 在e点 时c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 结论 |
| A | 向纯碱中滴加足量浓盐酸,将产生的气体通入硅酸钠溶液,溶液变浑浊 | 酸性:盐酸>碳酸>硅酸 |
| B | 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | SiO2可以和NaOH溶液及HF溶液反应 | SiO2属于两性氧化物 |
| D | 取某溶液少量,加入盐酸酸化的氯化钡溶液,出现白色沉淀 | 该溶液中一定含有大量的SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.配制0.10 mol•L-1 NaOH溶液 | B.制备少量氨气 |
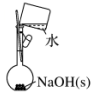 | 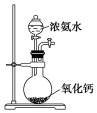 |
| C.称量氢氧化钠固体质量 | D.干燥氨气 |
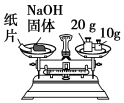 | 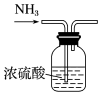 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸水溶液的pH<7:H2SO3?2H++SO32- | |
| B. | 将亚硫酸滴入饱和Na2CO3溶液有气泡产生:2H++CO32-═H2O+CO2↑ | |
| C. | Na2SO3溶液能使红色石蕊变蓝:SO32-+H2O═HSO3-+OH- | |
| D. | Na2SO3溶液中加入足量的酸化Ba(NO3)2溶液出现白色沉淀:3SO32-+2NO3-+2H++3Ba2+═3BaSO4↓+2NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑥⑦⑩ | B. | ①④⑧⑩ | C. | ③⑥⑦⑨ | D. | ③⑤⑦⑨ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com