
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
分析 (1)NaHCO3俗称小苏打,HCO3-水解使NaHCO3溶液显碱性;
(2)反应物为NaCl、NH3、CO2、H2O,产物为NaHCO3↓和NH4Cl,以此写出化学方程式;
(3)①普通泡沫灭火器是碳酸氢钠和硫酸铝溶液混合发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;
②碳酸根的水解是分步进行的,先水解得到碳酸氢根,进一步水解得到二氧化碳;
(4)①由表中数据可知,加入9.2g混合物时,盐酸有剩余,混合物完全反应,设9.2 g混合物中NaHCO3、KHCO3的物质的量分别为xmol、ymol,根据生成二氧化碳体积、二者质量之和列方程计算,再根据m=nM计算NaHCO3的质量,进而计算其质量分数;
②求盐酸浓度需选择盐酸不足量的数据进行,随着混合物质量增加,二氧化碳气体量不再增加,表明盐酸全部反应完,由表中数据可知,盐酸完全反应生成二氧化碳3.36L,结合H++HCO-3=H2O+CO2↑计算n(HCl),再利用c=$\frac{n}{V}$计算.
解答 解:(1)NaHCO3俗称小苏打,HCO3-水解使NaHCO3溶液显碱性,水解方程式为HCO3-+H2O?H2CO3+OH-,
故答案为:小苏打;HCO3-+H2O?H2CO3+OH-;
(2)先向饱和食盐水通入足量的NH3,再通入过量的CO2得到NaHCO3沉淀,化学方程式为NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl,
故答案为:NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl;
(3)①普通泡沫灭火器是碳酸氢钠和硫酸铝溶液混合发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,反应的离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
②Al2(SO4)3溶液和NaHCO3溶液混合后会发生双水解反应,原理方程式为:Al2(SO4)3+6NaHCO3═2Al(OH)3↓+6CO2↑+3Na2SO4,Al2(SO4)3溶液和NaHCO3溶液的体积比约是1:6,由1mol的碳酸根离子转化为1molCO2需2molH+,H+由Al3+提供(水解),在Al3+量不变的情况下,碳酸根离子先水解得到碳酸氢根,只能生成HCO3-,没有CO2,喷不出泡沫,并且双水解时NaHCO3表面生成Al(OH)3后,会阻碍反应的进行,
故答案为:不合理;等浓度、等体积的NaHCO3与Na2CO3相比,和Al2(SO4)3溶液反应时,NaHCO3生成的CO2既快又多;
(4)①由表中数据可知,加入9.2g混合物时,盐酸有剩余,混合物完全反应,设9.2 g混合物中NaHCO3、KHCO3的物质的量分别为xmol、ymol,
则有:xmol+ymol=$\frac{2.24L}{22.4L/mol}$①
84g/mol×xmol+100×ymol=9.2g ②
联立方程,解得:x=0.05 y=0.05,
故混合物中NaHCO3的质量为0.05mol×84g/mol=4.2g,NaHCO3的质量分数为$\frac{4.2g}{9.2g}$×100%=45.65%,
故答案为:45.65%;
②由表中数据可知,盐酸完全反应生成二氧化碳3.36L,结合H++HCO-3=H2O+CO2↑可知n(HCl)=$\frac{3.36L}{22.4L/mol}$=0.15mol,故盐酸的浓度为$\frac{0.15mol}{0.05L}$=3mol/L,
故答案为:3.
点评 本题考查了水解反应和混合物的有关计算,为高频考点,根据二氧化碳的体积变化判断盐酸是否完全反应式是关键,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | H+、Fe2+、Cl-、NO3- | B. | K+、H+、CO32-、HCO3- | ||
| C. | Ca2+、Ba2+、Cl-、HCO3- | D. | Na+、Ba2+、HCO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
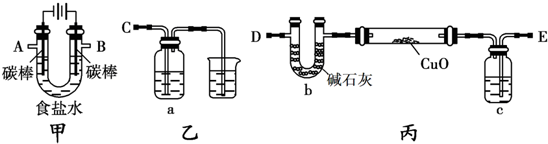
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (苯胺,易被氧化)
(苯胺,易被氧化) ;
; .
.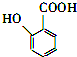 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有6种;其核磁共振氢谱图中峰面积之比为1:2:2:1,则符合上述条件的所有同分异构体的结构简式是
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有6种;其核磁共振氢谱图中峰面积之比为1:2:2:1,则符合上述条件的所有同分异构体的结构简式是 .
.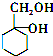 的合成路线流程图(自选无机试剂).合成路线流程图示例:
的合成路线流程图(自选无机试剂).合成路线流程图示例:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | 铝与Fe2O3发生铝热反应 | D. | 将铁钉投入Cu(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 硼化钒(VB2)、空气电池是目前储电能力最高的电池,电池示意图如图.该电池的反应产物分别是V2O5和B的最高价氧化物.下列说法正确的是( )
硼化钒(VB2)、空气电池是目前储电能力最高的电池,电池示意图如图.该电池的反应产物分别是V2O5和B的最高价氧化物.下列说法正确的是( )| A. | 图中选择性透过膜应只允许阴离子通过 | |
| B. | 电池工作过程中a电极附近溶液pH减小 | |
| C. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| D. | 如果负载为氯碱工业装置,外电路中转移0.1mol电子,则阴极生成气体1120mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
| A. | 向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀 | |
| B. | 向该混合溶液中逐滴加入NaOH溶液,最先看到白色沉淀 | |
| C. | 向该混合溶液中加入适量H2O2,并调节pH到3~4后过滤可获得纯净的CuSO4溶液 | |
| D. | 在pH=5的溶液中Fe3+不能大量存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有SO2和NO或NO2中的至少一种 | B. | 肯定只有NO | ||
| C. | 可能有Cl2和O2 | D. | 肯定没有Cl2、O2和NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 前四周期元素X、Y、Z、Q、R、W的原子序数依次增大.X基态原子的2p轨道为半充满状态;Y基态原子的L层有2个未成对电子;Z基态原子的最外层电子排布为3s23p2;Q、R、W都属于金属元素,Q、W基态原子核外均没有未成对电子,R基态原子的d轨道上有3个空轨道.
前四周期元素X、Y、Z、Q、R、W的原子序数依次增大.X基态原子的2p轨道为半充满状态;Y基态原子的L层有2个未成对电子;Z基态原子的最外层电子排布为3s23p2;Q、R、W都属于金属元素,Q、W基态原子核外均没有未成对电子,R基态原子的d轨道上有3个空轨道.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com