
[化学·选修3:物质结构与性质]请完成下列问题:
(1)某处于激发态的s原子,其中1个3s电子跃迁到3p轨道中,该激发态S原子的核外电子排布式为__________。
(2) Fe的基态原子共有__________种能量不同的电子。
(3)第二周期第一电离能介于B和N之间的元素有__________种。
(4)甲醇(CH3OH)中的羟基被硫羟基取代生成甲硫醇(CH3SH)。甲硫醇分子中S原子杂化轨道类型是__________。
(5) ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如右图所示,其晶胞边长为apm,a位置S2-与b位置Zn2+之间的距离为__________pm(列式表示)。
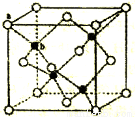
(6)磷酸盐分为直链多磷酸盐、支链状超磷酸盐和环状聚偏磷酸盐三类。某直链多磷酸钠的阴离子呈如下图所示的无限单链状结构,其中磷氧四面体通过共用顶角氧原子相连。则该多磷酸钠的化学式为__________。
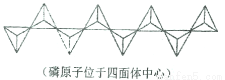
(7)碳化硅的晶胞结构(如下图)与金刚石类似(其中“●”为碳原子,“○”为硅原子),图中“●”点构成的堆积方式与下列图式中__________所表示的堆积方式相同。

(其中C为AB型D为ABC型)
 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源:2015-2016学年黑龙江双鸭山一中高二下期中化学试卷(解析版) 题型:选择题
苯酚有毒且有腐蚀性,使用时若不慎溅到皮肤上,可用来洗涤的试剂是( )
A.NaHCO3溶液 B.酒精 C.65℃以上的水 D.冷水
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三高考考前模拟十二化学试卷(解析版) 题型:选择题
阿托酸是一种常用的医药中间体,其结构如图所示: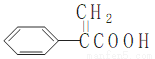 。下列有关说法中错误的是( )
。下列有关说法中错误的是( )
A.溴单质能与阿托酸发生加成反应
B.阿托酸能与硝酸发生取代反应
C.可用酸性KMnO4溶液区别阿托酸与苯
D.阿托酸分子中含有4个碳碳双键
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三下学期周考五理科综合化学试卷(解析版) 题型:填空题
黄铜矿是炼铜的最主要矿物,在野外很容易被误会为黄金,又称愚人金。
(1)向CuSO4溶液中加入过量的氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是
A.氨气极易溶于水,是因为NH3分子和水分子之间形成3种不同的氢键
B.[Cu(NH3)4]SO4组成元素中。N、O、S第一电离能大小顺序是O>N>S
C. [Cu(NH3)4]SO4所含有的化学键有离子键、极性键和配位键
D. NH3分子和H2O分子的空间构型不同,且氨气分子的键角小于水分子的键角
(2)Te位于周期表中__________族,H2Te比H2S沸点__________(填“高”或“低”)。某处于激发态的S原子,其中1个3s电子跃迁到3p轨道中,该激发态S原子的核外电子排布式为__________。
(3)S有+4和+6两种价态的氧化物,回答下列问题:
①下列关于气态SO3和SO2的说法中,正确的是__________
A.中心原子的价层电子对数目相等 B.都是极性分子
C.中心原子的孤对电子数目相等 D.都含有极性键
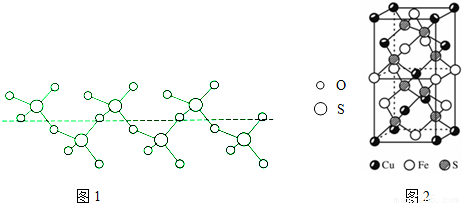
②将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图1,此固态SO3中S原子的杂化轨道类型是__________。
(4)Cu有+1和+2两种价态的化合物,回答下列问题:
①Cu+的价层轨道示意图为__________,Cu2+有__________个未成对电子.
②新制的Cu(OH)2能够溶解于过量浓碱溶液中,反应的离子方程式是
(5)CuFeS2的晶胞如图2所示,晶胞参数a=0.524nm,c=1.032nm;CuFeS2的晶胞中每个Cu原子与__________个S原子相连,列式计算晶体密度 ρ= __________g•cm-3.
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三下学期周考五理科综合化学试卷(解析版) 题型:选择题
下列实验能达到预期目的是( )
编号 | 实验内容 | 实验目的 |
A | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
B | 往黄色固体难溶物PbI2加水中振荡,静置取上层清液加入NaI固体,产生黄色沉淀 | 证明难溶物存在沉淀溶解平衡 |
C | 向10mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下Ksp: Mg(OH)2>Fe(OH)3 |
D | 室温下,用pH试纸分别测定浓度为0.1mol/LNaClO溶液和0.1mol/LCH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
查看答案和解析>>
科目:高中化学 来源:2016届安徽省六安市高三下综合训练十理综化学试卷(解析版) 题型:选择题
常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列说法中正确的是
A.该现象说明了NaHCO3难溶于水
B.滤液中的c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.滤液中c(Na+)+c(H+)+c(NH4+)= c(OH-)+ c(HCO3-)+c(CO32-)
D.滤液中c(Cl-)>c(NH4+)> c(HCO3-)> c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁鞍山一中高二下期中化学试卷(解析版) 题型:填空题
A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
A | A的第一电离能低于同周期左右相邻元素 |
B | B原子中成对电子数等于未成对电子数的2倍 |
C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
D | D与A、B、C均不同周期,其一个单质分子中只有一个σ键 |
E | E的原子序数比所处周期中未成对电子数最多的元素大3 |
(1)写出上述一种元素与氢元素形成的X2Y2型非极性分子的结构式:________。
(2)写出E元素的元素符号:________,其价电子排布图为:________。
(3)A与D形成化合物的化学式为________,是________分子(填“极性”或“非极性”)
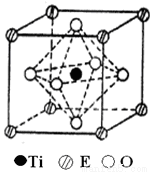
(4)在ETiO3晶胞中(结构如图2所示),1个Ti原子和1个E原子周围距离最近的O原子数目分别为________个、________个.
(5)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-.N3-的空间构型为________,叠氮化物能与E3+形成配合物,则[E(N3)(NH3)5]SO4中配体是________,E的配位数是________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁鞍山一中高二下期中化学试卷(解析版) 题型:选择题
下列有关说法不正确的是
A.共价键强弱可决定分子晶体的熔、沸点高低
B.O2、CO2、N2都是非极性分子
C.C3H8中碳原子都采用的是sp3杂化
D.CO的一种等电子体为NO+,它的电子式为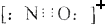
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃会宁一中高一下期中文科化学试卷(解析版) 题型:选择题
在理论上不能用于设计成原电池的化学反应是( )
A.HCl + NaOH = NaCl + H2O B.2CH3OH + 3O2= 2CO2 + 4H2O
C.4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3 D.2H2 + O2 = 2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com