
| A. | 2 min | B. | 3 min | C. | 6 min | D. | 9 min |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 推广使用煤的液化技术,从根本上减少二氧化碳等温室效应的排放 | |
| B. | 胶体和溶液的本质区别是胶体具有丁达尔现象 | |
| C. | SiO2既能与氢氧化钠溶液反应又能与氢氟酸反应,SiO2是两性氧化物 | |
| D. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO中有少量的NO2:用水洗涤后再干燥 | |
| B. | 食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干 | |
| C. | Cl2中有少量的HCl:通过氢氧化钠溶液洗气 | |
| D. | CO2中混有少量的SO2气体:通过饱和NaHSO3溶液洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2K+2H2O=2KOH+H2↑ | B. | Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3 | ||
| C. | 2Cu(NO3)2=2CuO+4NO2↑+O2↑ | D. | 3CO+Fe2O3=2Fe+3CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2与纯碱共熔 | B. | CO2通入Na2SiO3溶液 | ||
| C. | SiO2与大理石共熔 | D. | SiO2和浓H2SO4共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、SO42-、HCO3- | B. | K+、Na+、Cl-、SO42- | ||
| C. | K+、Cu2+、NO3-、SO42- | D. | K+、Fe2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 | |
| B. | 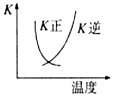 2SO2(g)+O2(g)?2SO3(g)△H<0的正、逆反应的平衡常数K随温度的变化可用图表示 | |
| C. | 2NO+2CO?2CO2+N2 △H<0,常温下该反应一定能自发进行 | |
| D. | FeCl3溶液和Fe2(SO4)3溶液加热蒸干.灼烧都得到Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
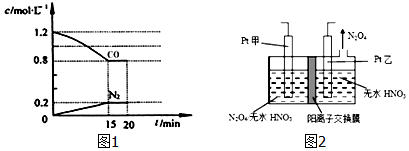
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com