
【题目】阿伏加德罗常数的值为NA。下列说法不正确的是
A. 15.6gNa2O2与过量CO2反应时,转移的电子数为0.2NA
B. 常温下,5.6g铁粉加入足量浓硝酸中反应,转移的电子数为0.3 NA
C. 常温下,4gCH4含有NA个C-H共价键
D. 分子总数为NA的ClO2和CO2混合气体中含有的氧原子数为2 NA
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素原子半径的相对大小、最高正价或最低负价的变化如下图所示。
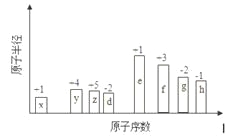
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的大小(用化学式表示,下同)_______>__________;比较g、h
的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在元素周期表中处于A、B位置的某些元素性质相似,这称为“对角线规则”。A为铍(Be),原子序数为4,B为铝(Al),下列有关其性质的推断正确的是
![]()
A. 铍能与冷水发生剧烈反应
B. 氢氧化铍既能与强酸溶液反应,又能与强碱溶液反应
C. 氢氧化铍的化学式为Be(OH)3
D. 氢氧化铍易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X﹑Y﹑Z﹑W﹑Q的原子序数逐渐增大。X原子核外最外层电子数是次外层电子数的2倍。Y的氟化物YF3分子中各原子均满足最外层8电子稳定结构。Z﹑W是常见金属,Z是同周期中原子半径最大的元素。W的简单离子是同周期中离子半径最小的。X和Z原子序数之和与Q的原子序数相等。下列说法正确的是
A. 相同质量的Z和W单质分别与足量稀盐酸反应时,Z的单质获得的氢气多
B. X与Q形成的化合物和Z与Q形成的化合物的化学键类型相同
C. 最高价氧化物对应的水化物的酸性:X<W
D. Y的简单气态氢化物与Q的单质反应,现象是产生白烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,能在溶液中大量共存且溶液呈透明的是( )
A.Mg2+ 、H+ 、Cu2+ 、SO42-B.Ba2+ 、NO3- 、OH- 、CO32--
C.Ag+ 、H+ 、Cl- 、NO3-D.K+ 、H+ 、Cl- 、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应发生在同种元素之间的是( )
A. Zn+2HCl![]() ZnCl2+H2↑
ZnCl2+H2↑
B. 2H2S+SO2![]() 3S↓+2H2O
3S↓+2H2O
C. H2+CuO![]() Cu+H2O
Cu+H2O
D. 2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用氨气为原料制备硝酸,其中有一步非常重要的反应为:4NH3+5O2![]() 4NO+6H2O,该反应的氧化剂为________,还原剂为________;用单线桥法表示该氧化还原反应电子转移的方向和数目:________;若有标准状况下VL氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为________(写出含字母的表达式)。
4NO+6H2O,该反应的氧化剂为________,还原剂为________;用单线桥法表示该氧化还原反应电子转移的方向和数目:________;若有标准状况下VL氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为________(写出含字母的表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用光洁铂丝蘸取某无色溶液,在无色火焰上灼烧,火焰呈黄色,则无色溶液中
A.只有Na+B.一定有Na+,可能有K+
C.一定有Na+和K+D.可能有Na+和K+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com