
【题目】某药物分子结构简式如图所示,下列关于该物质的说法不正确的是( )
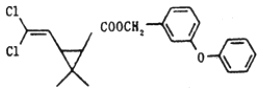
A.分子式为C21H20O3Cl2B.醚键上的氧原子至少与另外11个原子共面
C.该有机物最多与6molH2加成D.在一定条件下可发生加成、取代、氧化反应
科目:高中化学 来源: 题型:
【题目】实验室利用如图装置探究SO2还原CuO,并进一步检测产物含量。回答下列相关问题:

Ⅰ. SO2还原CuO探究
(1)装置A中发生反应的化学方程式_______________________________________。
(2)在制取SO2时,使用H2SO4溶液的浓度为__________时(填序号,从下列浓度中选取),制备SO2的速率明显快。请解释不选下列其它浓度硫酸的原因____________________。
a. 98% H2SO4 b.65% H2SO4 c. 5% H2SO4
(3)充分反应后,黑色固体变为红色。取C中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉淀物滴加盐酸,溶液又呈现蓝色并仍有少量红色不溶物,由此可以得出:
①已知SO2与CuO反应生成两种产物,写出该化学方程式___________________________。
②取红色沉淀物滴加盐酸,反应的离子方程式______________________________________。
Ⅱ.生成物中CuSO4含量检测
(4)用“碘量法”测定产物中CuSO4含量。取m g固体溶解于水配制成100mL溶液,取20.00mL溶液滴加几滴稀硫酸,再加入过量KI溶液,以淀粉为指示剂用Na2S2O3标准溶液滴定,相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I-![]() I3-,I2+2S2O32-=S4O62-+2I-。
I3-,I2+2S2O32-=S4O62-+2I-。
①若消耗0.1000mol/L Na2S2O3标准溶液VmL,则产物中CuSO4质量分数为____________。
②CuI沉淀物对I3—具有强的吸附能力,由此会造成CuSO4质量分数测定值_______(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按图进行电解实验(A、B、C、D均为惰性电极),可供选择的电解质溶液列于下表中。要求满足的条件是:
①工作一段时间后甲中溶液的pH上升,乙中溶液的pH下降;
②B、C两极上放电的离子的物质的量相等。

甲 乙
组别 | ① | ② | ③ | ④ |
甲烧杯 | NaOH溶液 | NaCl溶液 | H2SO4溶液 | AgNO3溶液 |
乙烧杯 | CuSO4溶液 | AgNO3溶液 | AgNO3溶液 | CuCl2溶液 |
(1)应选择的电解质溶液是________组。
(2)电极反应式:B极______________________;D极___________________________。
(3)当B极上析出3.55g电解产物时,C极将析出______(填物质名称)的质量为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某学生用0.100molL-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
实验编号 | KOH溶液的浓度(mol/L) | 滴定完成时,KOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)_____。
(2)根据上述数据,可计算出该盐酸的浓度约为_____(保留两位有效数字)
II.亚硫酸盐是一种常见食品添加剂。为检验某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组用“碘氧化还原滴定法”进行测定,实验流程如下:

(1)碘标准液应选用____(填“酸式”或“碱式”)滴定管盛装,加注标准液之前必须对滴定管进行查漏、洗涤、____。
(2)锥形瓶内的指示剂为_____,判断达到滴定终点的依据是________。
(3)下列操作会使测定结果偏大的有_______
A.起始读数时平视,终点读数时俯视
B.未用标准液润洗滴定管
C.步骤①中用稀盐酸代替稀硫酸
(4)若取样品w g,按乙方案测得消耗0.01000mol·L-1 I2溶液VmL,则1kg样品中含SO2的质量是____g(用含w、V的代数 )。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食用白醋的有效成分为醋酸(CH3COOH),可使用酸碱中和滴定法进行测定。现用标准NaOH溶液测定市售“上海白醋”的总酸量(g/100mL)。请填写实验报告中的空白处。
(实验目的)测定市售“上海白醋”的总酸量
(实验用品)蒸馏水,上海白醋,0.1000mol/LNaOH标准溶液,酚酞;100mL容量瓶,___________,玻璃棒,滴定管,锥形瓶,烧杯,铁架台及附件。
(实验步骤)
(1)配制并移取待测食醋溶液:
①用___________(填仪器名称)量取10.00mL食用白醋,注入烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得。
②取待测白醋溶液20.00 mL于锥形瓶中,并滴加2滴酚酞作指示剂。
(2)盛装标准NaOH溶液:滴定管经过洗涤后,装入NaOH标准溶液,使液面位于________________________________,记录滴定管的初读数。若液面位置如图所示,则此时的读数为____________mL。
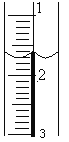
(3)滴定:当_____________________________________________时即为滴定终点。滴定到达终点后记录NaOH溶液的终点读数。再重复滴定3次。
(数据记录与处理)
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
待测食醋体积/mL | 20.00 | 20.00 | 20.00 | 20.00 |
滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
滴定管末读数/mL | 15.95 | 16.20 | 15.15 | 16.20 |
(4)甲同学在处理数据时计算得:消耗NaOH溶液的平均体积(V)=![]() =15.76 mL,指出计算的不合理之处:____________________________________________,
=15.76 mL,指出计算的不合理之处:____________________________________________,
(5)按正确数据处理计算,“上海白醋”的总酸量=___________g/100mL。
(思考与讨论)
(6)查看瓶示:总酸≥5g/100mL(以醋酸计),则此次测量的相对误差至少为________。
(7)下列操作中可能造成该测量误差的是____________(填序号)。
a. 未用标准NaOH溶液润洗滴定管 b. 锥形瓶在滴定时剧烈摇动,有少量液体溅出
c. 滴定前未赶走滴定管尖嘴中的气泡 d. 锥形瓶中加入待测白醋溶液后,再加少量水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2,FeCl3的升华温度为315℃。

实验操作和现象:
操作 | 现象 |
点燃酒精灯,加热 | ⅰ.A中部分固体溶解,上方出现白雾 ⅱ.稍后,产生黄色气体,管壁附着黄色液滴 ⅲ.B中溶液变蓝 |
(1)现象ⅰ中的白雾是___。
(2)分析现象ⅱ,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3·6H2O,产生白雾和黄色气体。
b.用KSCN溶液检验现象ⅱ和a中的黄色气体,溶液均变红。通过该实验说明现象ⅱ中黄色气体含有___。
(3)除了氯气可使B中溶液变蓝外,推测还可能的原因是:
①实验b检出的气体使之变蓝,反应的离子方程式是___。经实验证实推测成立。
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝。通过进一步实验确认了这种可能性,其实验方案是___。
(4)为进一步确认黄色气体是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1:在A、B间增加盛有某种试剂的洗气瓶C。
方案2:将B中KI淀粉溶液替换为NaBr溶液;检验Fe2+。
现象如下:
方案1 | B中溶液变为蓝色 |
方案2 | B中溶液呈浅橙红色,未检出Fe2+ |
①方案1的C中盛放的试剂是___(填字母)。
A.NaCl饱和溶液 B.NaOH溶液 C.NaClO溶液
②方案2中检验Fe2+的原因是___。
③综合方案1、2的现象,说明选择NaBr溶液的依据是___。
(5)将A中的产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组设计用含氯的有机物A合成棉织物免烫抗皱整理剂M的路线如下(部分反应试剂和条件未注明):

已知:①E的分子式为C5H8O4,能发生水解反应,核磁共振氢谱显示E分子内有2种不同化学环境的氢原子,其个数比为3∶1;

(R、R′、R″代表相同或不相同的烃基)。
(1)A分子中的含氧官能团的名称是________________。
(2)D→E反应的化学方程式是____________。
(3)A→B反应所需的试剂是________________。
(4)G→H反应的化学方程式是____________。
(5)已知1 mol E与2 mol J反应生成1 mol M,则M的结构简式是________。
(6)E的同分异构体有下列性质:①能与NaHCO3反应生成CO2;②能发生水解反应,且水解产物之一能发生银镜反应,则该同分异构体共有________种,其中任意1种的结构简式是________。
(7)J可合成高分子化合物,该高分子化合物的结构简式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为___。
(2)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还有少量杂质)是提取铝的原料。提取铝的工艺流程如下:
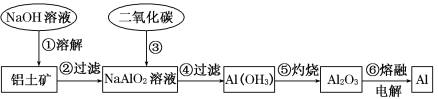
(1)请用离子方程式表示以上工艺流程中第①步反应:_____________________。
(2)写出以上工艺流程中第③步反应的离子方程式:___________________________。
(3)若第③步加入的是过量的盐酸,则发生反应的化学方程式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com