
| A. | 17g NH3和18 g H2O中含有的电子数均为10NA | |
| B. | 2 L 1.5 mol•L-1醋酸溶液中含有的CH3COO-数为3NA | |
| C. | 标准状况下,5.6 L Cl2溶解于足量NaOH溶液中,转移的电子数为0.5NA | |
| D. | 恒压密闭容器中充入2 mol NO与1 mol NO2,容器中分子数为3NA |
分析 A.质量转化为物质的量,结合1个氨气分子和1个水分子都含有10个电子解答;
B.醋酸为弱电解质,部分电离;
C.依据n=$\frac{V}{Vm}$计算氯气的物质的量,氯气与氢氧化钠溶液的反应中,氯气既是氧化剂也是还原剂;
D.二氧化氮可转化为四氧化二氮.
解答 解:A.17g NH3物质的量为$\frac{17g}{17g/mol}$=1mol,18 g H2O物质的量为$\frac{18g}{18g/mol}$=1mol,二者都含有的电子数为10NA,故A正确;
B.醋酸为弱电解质,部分电离,所以2 L 1.5 mol•L-1醋酸溶液中含有的CH3COO-数为3NA,故B错误;
C.标准状况下,5.6 L Cl2物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,1mol氯气与足量的NaOH溶液反应转移了1mol电子,故0.25mol氯气转移的电子数为0.25NA,故C错误;
D.因为存在二氧化氮与四氧化二氮的转化,所以恒压密闭容器中充入2 mol NO与1 mol NO2,容器中分子数小于3NA,故D错误;
故选:A.
点评 本题考查阿伏伽德罗常数的计算和应用,熟练掌握公式的使用和物质的结构是解题关键,注意物质的结构、弱电解质电离特点、二氧化氮与四氧化二氮之间的转化,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在101kPa时,1molS完全燃烧生成SO3时所放出的热量,是S的燃烧热 | |
| B. | 吸热反应必须加热才能反应,放热反应不需要加热 | |
| C. | 在101kPa时,1mol S和2mol S的燃烧热相同 | |
| D. | 在稀溶液中,H2SO4和Ba(OH)2完全中和产生1mol水时放出的热量为57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验目的 | 标号 |
| 检验氯化亚铁是否变质 | |
| 除去食盐中少量细砂 | |
| 除去碳酸钠固体中少量碳酸氢钠 | |
| 除去镁粉中混有的少量铝粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
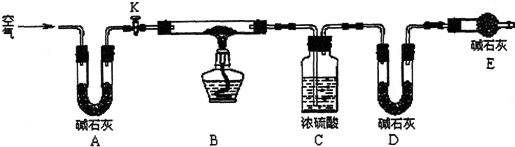
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
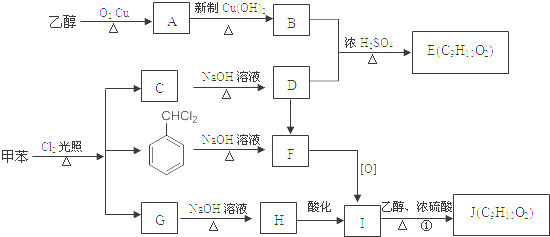

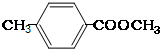
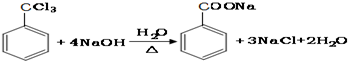 .
. ;②
;②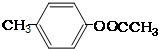 ;③
;③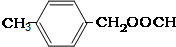 或
或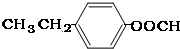 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| B. | 可用蘸有浓盐酸的棉棒检验输送氨气的管道是否漏气 | |
| C. | 碘是人体必需的微量元素,所以要多吃富含高碘酸的食物 | |
| D. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com